题目内容
可逆反应mA(固)+nB(气)?cC(气)+fD(气)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如下图所示,下列叙述正确的是( )


| A、达到平衡后,若使用催化剂,C的体积分数增大 |
| B、达到平衡后,若使温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中n>c+f |
| D、达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动 |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T2>T1,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即n<c+f,据此结合外界条件对化学平衡的影响分析解答.
解答:
解:可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T2>T1,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即n<c+f,
A、催化剂只改变化学反应速率,对平衡移动没有影响,C的体积分数不变,故A错误;
B、正反应为放热反应,升高温度平衡向吸热方向移动,即向逆反应移动,故B正确;
C、由上述分析可知,可逆反应mA(固)+nB(气)?cC(气)+fD(气)正反应为气体物质的量增大的反应,即n<c+f,故C错误;
D、达平衡后,增加A的量,因为A为固体,所以平衡不移动,故D错误;
故选B.
A、催化剂只改变化学反应速率,对平衡移动没有影响,C的体积分数不变,故A错误;
B、正反应为放热反应,升高温度平衡向吸热方向移动,即向逆反应移动,故B正确;
C、由上述分析可知,可逆反应mA(固)+nB(气)?cC(气)+fD(气)正反应为气体物质的量增大的反应,即n<c+f,故C错误;
D、达平衡后,增加A的量,因为A为固体,所以平衡不移动,故D错误;
故选B.
点评:本题考查化学平衡图象问题,题目难度中等,本题注意根据图象判断外界条件对平衡的移动的影响是解答该题的关键.

练习册系列答案
相关题目
若NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、NA个Fe(OH)3胶体粒子的质量为107g |
| B、8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA |
| C、9g重水(D2O)中所含质子数为5NA |
| D、2.3gNa与O2完全反应,反应中转移的电子数介于0.1NA到0.2NA之间 |
下列物质的电子式书写正确的是( )
A、HCl H+[:
| ||||||||
B、HClO H:
| ||||||||
C、H2O2 [H:
| ||||||||
D、Na2O2 Na+[:
|
某无色溶液可能含有AgNO3、NaCl、Na2CO3和Na2SO4中的一种.取少量该溶液于试管中,加入稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀产生.则该物质是( )
| A、AgNO3 |
| B、NaCl |
| C、Na2CO3 |
| D、Na2SO4 |

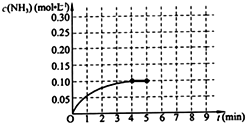 在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: