题目内容
某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是 .
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失.说明原溶液中肯定存在的离子是 ,有关的离子方程式为 .
(3)取(2)中的滤液,加入过量的稀氨水(NH3?H2O),出现白色沉淀,说明原溶液中肯定有 ,有关的离子方程式为 .
(4)原溶液可能大量存在的阴离子是下列的 .
A.Cl- B.NO3- C.CO32- D.OH-.
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失.说明原溶液中肯定存在的离子是
(3)取(2)中的滤液,加入过量的稀氨水(NH3?H2O),出现白色沉淀,说明原溶液中肯定有
(4)原溶液可能大量存在的阴离子是下列的
A.Cl- B.NO3- C.CO32- D.OH-.
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:(1)有颜色的离子不用做实验就能判断是否存在;
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有Ag+;
(3)能和NaOH溶液反应的离子是Mg2+;
(4)溶液中一定含银离子,与银离子结合生成沉淀的不能存在.
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有Ag+;
(3)能和NaOH溶液反应的离子是Mg2+;
(4)溶液中一定含银离子,与银离子结合生成沉淀的不能存在.
解答:
解:(1)有颜色的离子不用做实验就能判断是否存在,溶液无色说明不含Cu2+、Fe3+,故答案为:Cu2+、Fe3+;
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有Ag+,离子反应方程式为:Ag++Cl-=AgCl↓,故答案为:Ag+;Ag++Cl-=AgCl↓;
(3)能和NaOH溶液反应的离子是Mg2+,离子反应方程式为Mg2++2NH2?H2O═Mg(OH)2↓+2NH4+,故答案为:Mg2++2NH2?H2O═Mg(OH)2↓+2NH4+;
(4)原溶液中存在Ag+,则Cl- 不能共存,原溶液中肯定有Mg2+,故CO32-、OH-不能与其共存,硝酸根离子不与所给的任何离子生成沉淀,故溶液中可能大量存在的离子是硝酸根,故选B.
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有Ag+,离子反应方程式为:Ag++Cl-=AgCl↓,故答案为:Ag+;Ag++Cl-=AgCl↓;
(3)能和NaOH溶液反应的离子是Mg2+,离子反应方程式为Mg2++2NH2?H2O═Mg(OH)2↓+2NH4+,故答案为:Mg2++2NH2?H2O═Mg(OH)2↓+2NH4+;
(4)原溶液中存在Ag+,则Cl- 不能共存,原溶液中肯定有Mg2+,故CO32-、OH-不能与其共存,硝酸根离子不与所给的任何离子生成沉淀,故溶液中可能大量存在的离子是硝酸根,故选B.
点评:本题主要考查的是离子的检验,根据离子的颜色、离子之间的反应来分析解答,知道铁离子、亚铁离子、硫酸根离子、氯离子、铵根离子的检验方法及现象,题目难度不大.

练习册系列答案
相关题目
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A、氢氧化钠与盐酸;氢氧化铜与盐酸 |
| B、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
| C、Na2CO3溶液与硝酸溶液;CaCO3与硝酸溶液 |
| D、石灰石与硝酸反应;大理石与盐酸 |
可逆反应mA(固)+nB(气)?cC(气)+fD(气)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如下图所示,下列叙述正确的是( )
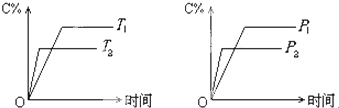

| A、达到平衡后,若使用催化剂,C的体积分数增大 |
| B、达到平衡后,若使温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中n>c+f |
| D、达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动 |
对未知的无机盐溶液里所含的离子作鉴定,根据下列实验事实作出的判断不一定正确的是( )
| A、加入烧碱溶液,微热时有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则原溶液中有NH4+ |
| B、加入盐酸无现象,再加BaCl2溶液,有白色沉淀生成,则原溶液中有SO42- |
| C、加入盐酸有无色气体逸出,该气体能使澄清石灰水变浑浊,则原溶液有CO32- |
| D、加入Ba(OH)2溶液,有白色沉淀生成,则原溶液中有 SO42- |
 X、Y、Z、W、T是短周期表中的5种主族元素.X基态原子核外L层p电子数等于s电子数.Y的一种核素的质量数为19,中子数比质子数多1.T-离子核外电子数与氩原子的核外电子数相同.X、Y、Z、W的第一电离能与它们的核电荷数的关系如图所示.
X、Y、Z、W、T是短周期表中的5种主族元素.X基态原子核外L层p电子数等于s电子数.Y的一种核素的质量数为19,中子数比质子数多1.T-离子核外电子数与氩原子的核外电子数相同.X、Y、Z、W的第一电离能与它们的核电荷数的关系如图所示.