题目内容
下列物质的电子式书写正确的是( )
A、HCl H+[:
| ||||||||
B、HClO H:
| ||||||||
C、H2O2 [H:
| ||||||||
D、Na2O2 Na+[:
|
考点:电子式
专题:化学用语专题
分析:A、氯化氢是H和Cl构成的共价化合物;
B、HClO分子中存在H-O和O-Cl两个共价键;
C、双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键;
D、Na2O2是钠离子和过氧根离子构成的离子化合物.
B、HClO分子中存在H-O和O-Cl两个共价键;
C、双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键;
D、Na2O2是钠离子和过氧根离子构成的离子化合物.
解答:
解:A、氯化氢是H和Cl构成的共价化合物,电子式为 ,故A错误;
,故A错误;
B、HClO分子中存在H-O和O-Cl两个共价键,次氯酸的电子式为: ,故B错误;
,故B错误;
C、双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故C错误;
,故C错误;
D、Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,故D正确;
,故D正确;
故选D.
 ,故A错误;
,故A错误;B、HClO分子中存在H-O和O-Cl两个共价键,次氯酸的电子式为:
 ,故B错误;
,故B错误;C、双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为:
 ,故C错误;
,故C错误;D、Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
 ,故D正确;
,故D正确;故选D.
点评:本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
 某无色溶液中只可能含有NH4+、K+、Al3+、Mg2+、Fe3+、Cl-、CO32-、SO42-等离子中的几种离子.下列说法正确的是( )
某无色溶液中只可能含有NH4+、K+、Al3+、Mg2+、Fe3+、Cl-、CO32-、SO42-等离子中的几种离子.下列说法正确的是( )①取10mL该溶液于试管中滴加Ba(NO3)2溶液并加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生.
②另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,沉淀的量与所加氢氧化钠溶液体积如图所示.
| A、溶液中一定存在的离子有K+、NH4+、Al3+、SO42- |
| B、溶液中一定不存在的离子有Cl-、Fe3+、Mg2+、K+、CO32- |
| C、实验中NaOH溶液的物质的量浓度为0.lmol/L |
| D、实验中无法确定K+的存在 |
标准状况下,112mL某气体的质量是0.14g,该气体可能是( )
| A、O |
| B、N2 |
| C、H2S |
| D、CO2 |
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A、氢氧化钠与盐酸;氢氧化铜与盐酸 |
| B、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
| C、Na2CO3溶液与硝酸溶液;CaCO3与硝酸溶液 |
| D、石灰石与硝酸反应;大理石与盐酸 |
化学用语是学习化学的重要工具,下列化学用语中,正确的是( )
| A、NH4+的水解反应离子方程式:NH4++H2O=NH3?H2O+H+ |
| B、在AgCl悬浊液中加入KI溶液充分振荡的离子方程式:Ag++I-=AgI↓ |
| C、镀铜时,阴极的电极反应式为:Cu2++2e-=Cu |
| D、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
可逆反应mA(固)+nB(气)?cC(气)+fD(气)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如下图所示,下列叙述正确的是( )
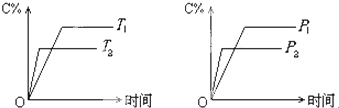

| A、达到平衡后,若使用催化剂,C的体积分数增大 |
| B、达到平衡后,若使温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中n>c+f |
| D、达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动 |
对未知的无机盐溶液里所含的离子作鉴定,根据下列实验事实作出的判断不一定正确的是( )
| A、加入烧碱溶液,微热时有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则原溶液中有NH4+ |
| B、加入盐酸无现象,再加BaCl2溶液,有白色沉淀生成,则原溶液中有SO42- |
| C、加入盐酸有无色气体逸出,该气体能使澄清石灰水变浑浊,则原溶液有CO32- |
| D、加入Ba(OH)2溶液,有白色沉淀生成,则原溶液中有 SO42- |
