题目内容
在标准状况下,铜与硝酸(浓)反应,生成4.48L二氧化氮,消耗硝酸的物质的量为 ,转移电子数目为 ,被还原的硝酸物质的量为 .
考点:化学方程式的有关计算
专题:
分析:铜与硝酸(浓)反应,发生反应:Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,根据方程式计算消耗硝酸的物质的量;生成1mol二氧化氮转移电子的物质的量为1mol,被还原的硝酸物质的量为参加反应硝酸的一半,由此分析解答.
解答:
解:Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O
4mol 44.8L
n(HNO3) 4.48L
所以n(HNO3)=0.4mol,所以被还原的硝酸物质的量为0.4mol×
=0.2mol,生成二氧化氮的物质的量为
=0.2mol,则转移电子的物质的量为0.2mol,即转移电子数为0.2NA,故答案为:0.4mol;0.2NA;0.2mol;
4mol 44.8L
n(HNO3) 4.48L
所以n(HNO3)=0.4mol,所以被还原的硝酸物质的量为0.4mol×
| 1 |
| 2 |
| 4.48L |
| 22.4L/mol |
点评:本题考查化学方程式有关计算,明确发生的反应是关键,难度不大,注意理解掌握化学方程式表示意义.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
标准状况下,112mL某气体的质量是0.14g,该气体可能是( )
| A、O |
| B、N2 |
| C、H2S |
| D、CO2 |
可逆反应mA(固)+nB(气)?cC(气)+fD(气)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如下图所示,下列叙述正确的是( )
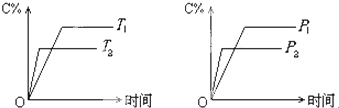

| A、达到平衡后,若使用催化剂,C的体积分数增大 |
| B、达到平衡后,若使温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中n>c+f |
| D、达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动 |
对未知的无机盐溶液里所含的离子作鉴定,根据下列实验事实作出的判断不一定正确的是( )
| A、加入烧碱溶液,微热时有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则原溶液中有NH4+ |
| B、加入盐酸无现象,再加BaCl2溶液,有白色沉淀生成,则原溶液中有SO42- |
| C、加入盐酸有无色气体逸出,该气体能使澄清石灰水变浑浊,则原溶液有CO32- |
| D、加入Ba(OH)2溶液,有白色沉淀生成,则原溶液中有 SO42- |
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?cC(g),符合如图所示的关系(c%表示混合气中产物C的百分含量,T表示温度,P表示压强,t表示时间).在图中,Y轴是指( )
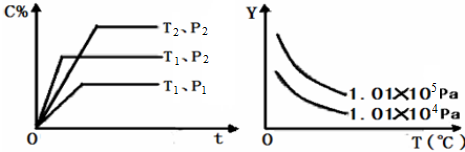

| A、平衡混合气中物质A的百分含量 |
| B、平衡混合气中物质B的百分含量 |
| C、平衡混合气的平均摩尔质量 |
| D、平衡混合气的密度 |