题目内容
12.煤燃烧的反应热可通过以下两个途径来利用:A.利用煤在充足的空气中直接燃烧产生的反应热;B.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的热化学方程式为:A.C(s)+O2(g)═CO2(g)△H=E1①
B.C(s)+H2O(g)═H2(g)+CO(g)△H=E2②
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=E3③
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=E4④
完成下列问题:
(1)上述四个反应中属于吸热反应的有②.(填序号)
(2)等量的煤分别通过以上两条不同的途径产生的热量(理论上)关系正确的是B.
A.a>b B.a=b C.a<b
(3)根据上述两个途径的关系,写出E4的数学表达式:E4=E1-E2-E3.
分析 (1)燃烧反应均为放热反应,C与水蒸气的反应为吸热反应;
(2)根据盖斯定律可知,反应一步完成或分步完成,其热效应相同;
(3)由盖斯定律可知:①=②+③+④,反应热也进行相应的计算.
解答 解:(1)因为燃烧反应均为放热反应,①③④为燃烧反应,属于放热反应,△H<0,②为吸热反应,△H>0;
故答案为:②;
(2)由盖斯定律可知,反应一步完成或分步完成,其热效应相同,则等质量的煤分别通过以上两条不同的途径产生的可利用的总能量相同,
故答案为:B;
(3)由盖斯定律可知,反应一步完成或分步完成,其热效应相同,所以①=②+③+④,则能量为E1=E2+E3+E4,即E4=E1-E2-E3,
故答案为:E4=E1-E2-E3.
点评 本题考查化学反应中的能量变化及利用盖斯定律确定反应及其能量的关系,为高频考点,侧重在于学生的分析能力的考查,题目较简单,注重基础知识的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.某兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,用0.1000mol•L-1标准盐酸润洗2~3次后,再向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点时,记下读数.
④再进行两次滴定,记下读数.
试回答下列问题:
(1)该小组在步骤①中的错误操作是用待测液润洗锥形瓶_,由此造成的测定结果偏高(填“偏高”、“偏低”或“无影响”).
(2)步骤②中酸式滴定管用标准酸液润洗2~3次的目的是确保标准盐酸溶液的浓度不发生变化.
(3)步骤③中滴定终点如何判断:锥形瓶内溶液由红色变为无色,且半分钟内颜色不再改变.
(4)该小组同学所做三次平行实验的数据记录如下:
请计算所测烧碱溶液的浓度为0.1250mol•L-1.
①将碱式滴定管用蒸馏水洗净,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,用0.1000mol•L-1标准盐酸润洗2~3次后,再向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点时,记下读数.
④再进行两次滴定,记下读数.
试回答下列问题:
(1)该小组在步骤①中的错误操作是用待测液润洗锥形瓶_,由此造成的测定结果偏高(填“偏高”、“偏低”或“无影响”).
(2)步骤②中酸式滴定管用标准酸液润洗2~3次的目的是确保标准盐酸溶液的浓度不发生变化.
(3)步骤③中滴定终点如何判断:锥形瓶内溶液由红色变为无色,且半分钟内颜色不再改变.
(4)该小组同学所做三次平行实验的数据记录如下:
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第1次 | 20.00 | 4.10 | 29.10 |
| 第2次 | 20.00 | 0.00 | 24.90 |
| 第3次 | 20.00 | 4.00 | 29.10 |
7. 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
操作如下:
①在50mL圆底烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填“a”或“b”)端管口通入.
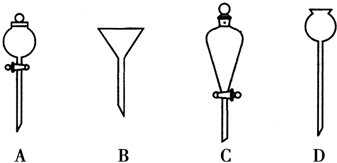
(2)进行分液操作时,使用的漏斗是C(填选项).
(3)仪器A中乙酸和正丁醇制备乙酸正丁酯的化学方程为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)步骤①“不断分离除去反应生成的水”的目的是使用分水器分离出水,使平衡正向移动,提高反应产率.
(5)步骤②中用10% Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(6)乙酸正丁酯的产率为65%.
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | 溶解度 /(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL圆底烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填“a”或“b”)端管口通入.
(2)进行分液操作时,使用的漏斗是C(填选项).

(3)仪器A中乙酸和正丁醇制备乙酸正丁酯的化学方程为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)步骤①“不断分离除去反应生成的水”的目的是使用分水器分离出水,使平衡正向移动,提高反应产率.
(5)步骤②中用10% Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(6)乙酸正丁酯的产率为65%.
2.下列有关电解质溶液的说法正确的是( )
| A. | 用CH3COOH溶液做导电实验,灯泡很暗,证明CH3COOH是弱电解质 | |
| B. | pH相同的醋酸和盐酸,取等体积的两种酸溶液分别稀释至原溶液体积的m倍和n倍,稀释后两溶液的pH仍然相同,则m<n | |
| C. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小且c(NH4+)/c(NH3•H2O)的值增大 | |
| D. | 常温下,CH3COOH的Ka=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O的溶液中的c(OH-)相等 |