题目内容
11.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②继续向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
根据上述实验事实,回答下列问题:
(1)通过①说明溶液中一定没有什么离子?Cu2+
(2)原白色粉末中一定含有的物质是Ba(NO3)2、Na2CO3,一定不含有的物质是CuSO4(写化学式)
(3)写出各步变化的离子方程式.
①Ba2++CO32-=BaCO3↓;
②BaCO3+2H+=Ba2++CO2↑+H2O;
③Ba2++SO42-=BaSO4↓.
分析 ①将部分粉末加入水中,溶液呈无色,说明一定不含有CuSO4;振荡,有白色沉淀生成,说明一定含有Ba(NO3)2、Na2CO3生成碳酸钡白色沉淀;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,证明是碳酸钡沉淀;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明生成的是硫酸钡沉淀,以此来解答.
解答 解:①将部分粉末加入水中,溶液呈无色,说明一定不含有CuSO4;振荡,有白色沉淀生成,说明一定含有Ba(NO3)2、Na2CO3生成碳酸钡白色沉淀;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,证明是碳酸钡沉淀;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明生成的是硫酸钡沉淀,
(1)由上述分析可知,①说明溶液中一定没有Cu2+,故答案为:Cu2+;
(2)由上述分析可知,原白色粉末中一定含有的物质是Ba(NO3)2、Na2CO3,一定不含有的物质是CuSO4,故答案为:Ba(NO3)2、Na2CO3;CuSO4;
(2)①固体混合得到白色沉淀和无色溶液,一定不含有CuSO4,生成沉淀的是Ba(NO3)2、Na2CO3,生成的碳酸钡沉淀,反应的离子方程式为Ba2++CO32-=BaCO3↓,
故答案为:Ba2++CO32-=BaCO3↓;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,是碳酸钡沉淀溶于稀硝酸生成二氧化碳气体,反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明生成的是硫酸钡沉淀,反应的离子方程式为Ba2++SO42-=BaSO4↓,故答案为:Ba2++SO42-=BaSO4↓.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应及现象等为解答的关键,侧重分析与推断能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 甲醛溶液 | B. | 饱和(NH4)2SO4溶液 | C. | 75%酒精 | D. | 硫酸铜溶液 |
| A. | 加热会聚沉 | B. | 产生丁达尔现象 | ||
| C. | 胶体微粒不能透过半透膜 | D. | 分散质颗粒大小在1-100nm之间 |
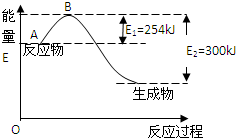 氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:
氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:(1)如图是氮气和氢气反应生成1mol氨气的能量变化示意图,写出上述反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol
(2)已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/( kJ/mol) | 435 | 943 |
(3)用氨催化还原NOx(氮氧化物),可消除污染.
已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-a kJ/mol
N2(g)+O2(g)═2NO(g)△H2=-b kJ/mol
则反应:4NH3(g)+6NO(g)═5N2(g)+6H2O(g) 的反应热△H=-(a+3b)kJ/mol (用含a和b的代数式表示)其中氧化剂是NO,还原剂是NH3(均填分子式)

| A. | c电极的名称为正极,d电极上的电极反应式为CH4-8e-+4O2-═CO2+2H2O | |
| B. | 如图2所示,a电极上的电极反应式为4OH--4e-═2H2O+O2↑ | |
| C. | 如图2所示电解100mL0.5mol/LCuSO4溶液,若a电极产生56mL(标准状况)气体,则所得溶液的pH=1(不考虑溶液体积变化) | |
| D. | 若要使电解质溶液恢复到电解前的状态,可加入Cu2(OH)2CO3 |
| A. | 还原性 | B. | 氧化性 | C. | 脱水性 | D. | 吸水性 |
 霞石是一种硅酸盐,其组成可表示为K2O•3Na2O•4Al2O3•8SiO2.某小组同学设计以霞石为原料制备Al2O3的方案如下:
霞石是一种硅酸盐,其组成可表示为K2O•3Na2O•4Al2O3•8SiO2.某小组同学设计以霞石为原料制备Al2O3的方案如下: