题目内容
大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据.
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中的溶质及物质的量为 .
(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为: .
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为 .
(5)已知在常温常压下:①CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-359.8kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)?△H=-556.0kJ?mol-1
③H2O(g)=H2O(l)?△H=-44.0kJ?mol-1
写出体现甲醇燃烧热的热化学方程式 .
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中的溶质及物质的量为
(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程为
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为
(5)已知在常温常压下:①CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-359.8kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)?△H=-556.0kJ?mol-1
③H2O(g)=H2O(l)?△H=-44.0kJ?mol-1
写出体现甲醇燃烧热的热化学方程式
考点:二氧化硫的污染及治理,离子方程式的书写,物质的量的相关计算,用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来分析回答;
(2)碱性条件下CO在负极放电生成CO32-;
(3)催化剂的特点,恢复原来状态,Fe3+→Fe2+;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍;
(5)根据盖斯定律,由已知热化学方程式构造目标热化学方程式.
(2)碱性条件下CO在负极放电生成CO32-;
(3)催化剂的特点,恢复原来状态,Fe3+→Fe2+;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍;
(5)根据盖斯定律,由已知热化学方程式构造目标热化学方程式.
解答:
解:(1)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物,则设生成碳酸钠和碳酸氢钠的物质的量分别为xmol和ymol,根据Na、C守恒得:
,解得x=y=0.2mol;故答案为:0.2molNa2CO3与0.2molNaHCO3;
(2)原电池中,负极上CO失电子和氢氧根离子反应生成CO32-,所以电极反应式为:CO+4OH--2e-=CO32-+2H2O,
故答案为:CO+4OH--2e-=CO32-+2H2O;
(3)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
故答案为:2Fe3++SO2+2H2 O═2Fe2++SO42-+4H+;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=
×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)=2.8×10-9可知,c(Ca2+)=
mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L;
故答案为:5.6×10-5mol/L;
(5)已知:①CH3OH(l)+O2(g)═CO(g)+2H2O(g);△H=-359.8kJ?mol-1
②2CO(g)+O2(g)═2CO2(g);△H=-556.0kJ?mol-1
③H2O(g)═H2O(l);△H=-44.0kJ?mol-1
根据盖斯定律:①+
×②+2×③得CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.8 kJ?mol-1;
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.8 kJ?mol-1.
|
(2)原电池中,负极上CO失电子和氢氧根离子反应生成CO32-,所以电极反应式为:CO+4OH--2e-=CO32-+2H2O,
故答案为:CO+4OH--2e-=CO32-+2H2O;
(3)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
故答案为:2Fe3++SO2+2H2 O═2Fe2++SO42-+4H+;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=
| 1 |
| 2 |
| 2.8×10 -9 |
| 1×10 -4 |
故答案为:5.6×10-5mol/L;
(5)已知:①CH3OH(l)+O2(g)═CO(g)+2H2O(g);△H=-359.8kJ?mol-1
②2CO(g)+O2(g)═2CO2(g);△H=-556.0kJ?mol-1
③H2O(g)═H2O(l);△H=-44.0kJ?mol-1
根据盖斯定律:①+
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
点评:本题考查了盐的水解,溶度积常数的有关计算,热化学方程式和盖斯定律的计算应用,原电池的应用等,涉及的知识点较多,题目难度中等,注意是对反应原理的应用的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol?L-1的NaA和NaB混合溶液中,下列排序正确的是( )
| A、c(OH-)>c(HA)>c(HB)>c(H+) |
| B、c(OH-)>c(A-)>c(B-)>c(H+) |
| C、c(OH-)>c(B-)>c(A-)>c(H+) |
| D、c(OH-)>c(HB)>c(HA)>c(H+) |
利尿酸是奥运会禁止使用的兴奋剂之一,其结构简式如图.下列有关利尿酸的说法中正确的是( )

| A、分子式是C13H14O4Cl2 |
| B、1mol利尿酸最多能与5mol H2发生加成反应 |
| C、-定条件下能发生加聚、缩聚反应 |
| D、分子中所有碳原子不可能共平面 |
某原电池装置如图所示,下列有关叙述中,不正确的是( )
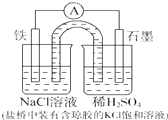

| A、Fe作负极,发生氧化反应 |
| B、盐桥的作用是平衡电荷,构成闭合回路 |
| C、工作一段时间后,NaCl溶液中c(Cl-)不变 |
| D、正极反应:2H++2e-=H2↑ |
标准状况下,若V L氧气含有的氧分子数为N,则阿伏加德罗常数可表示为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列推断合理的是( )
| A、Cu的活动性排在H之后,不能与浓H2SO4发生反应 |
| B、金刚石是自然界中硬度最大的物质,不能氧气发生反应 |
| C、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
某无色酸性溶液中能大量共存的离子组是( )
| A、K+、Mg2+、Cl-、NO3- |
| B、Ba2+、SO42-、Cl-、OH- |
| C、K+、OH-、CO32-、MnO4- |
| D、Ca2+、K+、Cl-、HCO3- |