题目内容
某原电池装置如图所示,下列有关叙述中,不正确的是( )
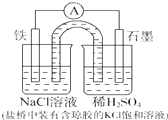

| A、Fe作负极,发生氧化反应 |
| B、盐桥的作用是平衡电荷,构成闭合回路 |
| C、工作一段时间后,NaCl溶液中c(Cl-)不变 |
| D、正极反应:2H++2e-=H2↑ |
考点:原电池和电解池的工作原理
专题:
分析:铁为负极,被氧化,电极反应为Fe-2e-=Fe2+,石墨为正极,发生还原反应,电极反应为2H++2e-=H2↑,结合电极反应解答.
解答:
解:A.铁为负极,发生氧化反应,故A正确;
B.盐桥的作用是平衡电荷,构成闭合回路,故B正确;
C.铁为负极,氯离子向负极移动,则浓度增大,故C错误;
D.右烧杯为正极发生2H++2e-=H2↑,故D正确.
故选C.
B.盐桥的作用是平衡电荷,构成闭合回路,故B正确;
C.铁为负极,氯离子向负极移动,则浓度增大,故C错误;
D.右烧杯为正极发生2H++2e-=H2↑,故D正确.
故选C.
点评:本题考查原电池知识,侧重于原电池的工作原理的考查,为高考高频考点,注意把握电极反应的判断,把握电极方程式的书写,为解答该类题目的关键,难度不大.

练习册系列答案
相关题目
物质在反应中可表现氧化性、还原性、酸性、碱性等,下面方程式中划线的物质,能在同一反应中同时表现上述两种或两种以上性质的有( )
①3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O
②C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
③8NH3+3Cl2=6NH4Cl+N2
④2Na2O2+2H2O=4NaOH+O2↑
①3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O
②C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
③8NH3+3Cl2=6NH4Cl+N2
④2Na2O2+2H2O=4NaOH+O2↑
| A、①②③ | B、①③④ |
| C、②③④ | D、全部 |
根据图装置判断下列说法错误的是( )


| A、铜片上有大量气泡产生 |
| B、铜片上发生氧化反应 |
| C、锌片为负极 |
| D、该装置将化学能转化为电能 |

