题目内容
明矾石主要成份是KAl(SO4)2,还含有FeO、Fe2O3、SiO2杂质,工业为了获取明矾[KAl(SO4)2、12H2O],首先选矿,再用过量稀H2SO4处理矿石,过滤除去滤渣,再向滤液中加入H2O2溶液,调节溶液PH=4.5左右,过滤,再将滤液进行处理获取纯净明矾,将所得明矾进行如下流程处理,制备Al、K2SO4和H2SO4.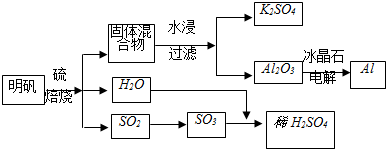
请回答下列问题:
(1)实验室将K2SO4溶液制备K2SO4晶体,使用瓷器是 ,制得晶体的方法是 .
(2)配平下列反应化学方程式: KAl(SO4)2?12H2O+ S
K2SO4+ Al2O3+ SO2+ H2O
(3)明矾石用稀H2SO4处理后的滤液中,加入H2O2调节PH=4.5的目的是 .并写出加入H2O2的离子反应方程式 .
(4)用冶炼制得的Al和NiO(OH)2为电极,NaOH溶液为电解质溶液,生产一种新型铝镍充电电池,电池放电时,两极都生成金属氢氧化物,电池总反应方程式是 ,充电时,阳极电极反应式是 .
(5)焙烧产生的SO2可用于制H2SO4,已知25°C,101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197KJ/mol
H2O(g)?H2O(l)△H2=-44KJ/mol
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545KJ/mol
则SO3(g)与H2O(l)反应的热化学方程式是 .
(6)焙烧2370t明矾(M=474g/mol),若SO2利用率为96%,结晶水利用率为100%,生产的SO3用结晶水吸收,则所得H2SO4溶液质量分数是 (保留一位小数).

请回答下列问题:
(1)实验室将K2SO4溶液制备K2SO4晶体,使用瓷器是
(2)配平下列反应化学方程式:
| ||
(3)明矾石用稀H2SO4处理后的滤液中,加入H2O2调节PH=4.5的目的是
(4)用冶炼制得的Al和NiO(OH)2为电极,NaOH溶液为电解质溶液,生产一种新型铝镍充电电池,电池放电时,两极都生成金属氢氧化物,电池总反应方程式是
(5)焙烧产生的SO2可用于制H2SO4,已知25°C,101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197KJ/mol
H2O(g)?H2O(l)△H2=-44KJ/mol
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545KJ/mol
则SO3(g)与H2O(l)反应的热化学方程式是
(6)焙烧2370t明矾(M=474g/mol),若SO2利用率为96%,结晶水利用率为100%,生产的SO3用结晶水吸收,则所得H2SO4溶液质量分数是
考点:物质分离和提纯的方法和基本操作综合应用,用盖斯定律进行有关反应热的计算,电解原理
专题:
分析:明矾石主要成份是KAl(SO4)2,还含有FeO、Fe2O3、SiO2杂质,首先选矿,再用过量稀H2SO4处理矿石,FeO、Fe2O3溶于稀硫酸,SiO2不溶,过滤除去滤渣,再向滤液中加入H2O2溶液,亚铁离子被氧化为铁离子,调节溶液PH=4.5左右,铁离子转化为氢氧化铁沉淀,过滤,再将滤液进行处理获取纯净明矾,将所得明矾,加S焙烧,生成二氧化硫、水和固体化合物,固体化合物中含有K2SO4、Al2O3,水浸,K2SO4溶于水形成溶液,过滤得到Al2O3,再电解得到Al;
(1)K2SO4溶液制备K2SO4晶体,在蒸发皿中蒸发掉溶剂即可;
(2)反应物KAl(SO4)2?12H2O中S元素从+6价降低到+4价,单质S中化合价从0价升高到+4价,根据得失电子守恒和原子守恒配平;
(3)H2O2能把Fe2+氧化成Fe3+,Fe3+易水解生成氢氧化铁沉淀;
(4)Al和NiO(OH)2为电极,NaOH溶液为电解质溶液,发生原电池反应生成Ni(OH)2和Al(OH)3;充电时,阳极上Ni(OH)2失电子转化为NiO(OH)2;
(5)利用盖斯定律,将热化学方程式进行运算,计算反应的焓变;
(6)依据硫元素守恒计算得到硫酸的质量,硫酸的质量除以硫酸和水的总质量即是H2SO4溶液质量分数.
(1)K2SO4溶液制备K2SO4晶体,在蒸发皿中蒸发掉溶剂即可;
(2)反应物KAl(SO4)2?12H2O中S元素从+6价降低到+4价,单质S中化合价从0价升高到+4价,根据得失电子守恒和原子守恒配平;
(3)H2O2能把Fe2+氧化成Fe3+,Fe3+易水解生成氢氧化铁沉淀;
(4)Al和NiO(OH)2为电极,NaOH溶液为电解质溶液,发生原电池反应生成Ni(OH)2和Al(OH)3;充电时,阳极上Ni(OH)2失电子转化为NiO(OH)2;
(5)利用盖斯定律,将热化学方程式进行运算,计算反应的焓变;
(6)依据硫元素守恒计算得到硫酸的质量,硫酸的质量除以硫酸和水的总质量即是H2SO4溶液质量分数.
解答:
解:明矾石主要成份是KAl(SO4)2,还含有FeO、Fe2O3、SiO2杂质,首先选矿,再用过量稀H2SO4处理矿石,FeO、Fe2O3溶于稀硫酸,SiO2不溶,过滤除去滤渣,再向滤液中加入H2O2溶液,亚铁离子被氧化为铁离子,调节溶液PH=4.5左右,铁离子转化为氢氧化铁沉淀,过滤,再将滤液进行处理获取纯净明矾,将所得明矾,加S焙烧,生成二氧化硫、水和固体化合物,固体化合物中含有K2SO4、Al2O3,水浸,K2SO4溶于水形成溶液,过滤得到Al2O3,再电解得到Al;
(1)K2SO4溶液制备K2SO4晶体,在蒸发皿中蒸发掉溶剂即可,所以用到的瓷器是蒸发皿,K2SO4在溶液中不水解,受热不分解,所以直接加热蒸干即可;
故答案为:蒸发皿;加热蒸干;
(2)反应物KAl(SO4)2?12H2O中S元素从+6价降低到+4价,则降低了2价,单质S中化合价从0价升高到+4价,升高了4价,由得失电子守恒和原子守恒配平为:4KAl(SO4)2?12H2O+3S
2K2SO4+2Al2O3+9SO2+48H2O;
故答案为:4,3,2,2,9,48;
(3)H2O2能把Fe2+氧化成Fe3+,Fe3+易水解生成氢氧化铁沉淀,所以加入H2O2调节PH=4.5可以将Fe2+完全氧化成Fe3+,有利于Fe3+完全水解生成Fe(OH)3沉淀而除去,双氧水与亚亚铁离子反应生成铁离子和水的离子方程式为:H2O2+2Fe2++2H+=2H2O+2Fe3+;
故答案为:将Fe2+完全氧化成Fe3+,有利于Fe3+完全水解生成Fe(OH)3沉淀而除去;H2O2+2Fe2++2H+=2H2O+2Fe3+;
(4)Al和NiO(OH)2为电极,NaOH溶液为电解质溶液,发生原电池反应生成Ni(OH)2和Al(OH)3,则电池总反应方程式是3NiO(OH)+Al+3H2O=3Ni(OH)2+Al(OH)3;充电时,阳极上Ni(OH)2失电子转化为NiO(OH)2,则阳极的电极反应式为:Ni(OH)2+2OH--2e-=NiO(OH)2+H2O;
故答案为:3NiO(OH)+Al+3H2O=3Ni(OH)2+Al(OH)3;Ni(OH)2+2OH--2e-=NiO(OH)2+H2O;
(5)2SO2(g)+O2(g)=2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=-88kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①-②)×
得SO3 (g)+H2O(l)=H2SO4(l)△H=-130kJ/mol,
SO3(g) )+H2O(g)=H2SO4(l)△H3=-130kJ/mol,
故答案为:SO3(g) )+H2O(l)=H2SO4(l)△H3=-130kJ/mol;
(6)4KAl(SO4)2?12H2O~9SO2~24H2O SO2~H2O~H2SO4
4×474 9×64 48×18 64 18 98
2370t xt yt x×96% wt zt
解得:x=720,y=1080,w=194.4,z=1058.4,
则H2SO4溶液质量分数:
×100%=54.4%;
故答案为:54.4%.
(1)K2SO4溶液制备K2SO4晶体,在蒸发皿中蒸发掉溶剂即可,所以用到的瓷器是蒸发皿,K2SO4在溶液中不水解,受热不分解,所以直接加热蒸干即可;
故答案为:蒸发皿;加热蒸干;
(2)反应物KAl(SO4)2?12H2O中S元素从+6价降低到+4价,则降低了2价,单质S中化合价从0价升高到+4价,升高了4价,由得失电子守恒和原子守恒配平为:4KAl(SO4)2?12H2O+3S
| ||
故答案为:4,3,2,2,9,48;
(3)H2O2能把Fe2+氧化成Fe3+,Fe3+易水解生成氢氧化铁沉淀,所以加入H2O2调节PH=4.5可以将Fe2+完全氧化成Fe3+,有利于Fe3+完全水解生成Fe(OH)3沉淀而除去,双氧水与亚亚铁离子反应生成铁离子和水的离子方程式为:H2O2+2Fe2++2H+=2H2O+2Fe3+;
故答案为:将Fe2+完全氧化成Fe3+,有利于Fe3+完全水解生成Fe(OH)3沉淀而除去;H2O2+2Fe2++2H+=2H2O+2Fe3+;
(4)Al和NiO(OH)2为电极,NaOH溶液为电解质溶液,发生原电池反应生成Ni(OH)2和Al(OH)3,则电池总反应方程式是3NiO(OH)+Al+3H2O=3Ni(OH)2+Al(OH)3;充电时,阳极上Ni(OH)2失电子转化为NiO(OH)2,则阳极的电极反应式为:Ni(OH)2+2OH--2e-=NiO(OH)2+H2O;
故答案为:3NiO(OH)+Al+3H2O=3Ni(OH)2+Al(OH)3;Ni(OH)2+2OH--2e-=NiO(OH)2+H2O;
(5)2SO2(g)+O2(g)=2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=-88kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①-②)×
| 1 |
| 2 |
SO3(g) )+H2O(g)=H2SO4(l)△H3=-130kJ/mol,
故答案为:SO3(g) )+H2O(l)=H2SO4(l)△H3=-130kJ/mol;
(6)4KAl(SO4)2?12H2O~9SO2~24H2O SO2~H2O~H2SO4
4×474 9×64 48×18 64 18 98
2370t xt yt x×96% wt zt
解得:x=720,y=1080,w=194.4,z=1058.4,
则H2SO4溶液质量分数:
| 1058.4 |
| 1058.4+1080-194.4 |
故答案为:54.4%.
点评:本题考查了氧化还原反应、实验基本操作、原电池电池和电解池反应方程式、热化学方程式、计算等,侧重于考查考生框图推断能力、分析计算能力、知识应用能力,试题难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
烃分子中若含有双键,叁键或环,其碳原子所结合的氢原子则少于同碳原子数对应烷烃所含的氢原子数,亦具有一定的不饱和度(用Ω表示),下表列出几种烃的不饱和度:据此下列说法不正确的是:( )
| 有机物 | 乙烯 | 乙炔 | 环已烷 | 苯 |
| Ω | 1 | 2 | 1 | 4 |
| A、1molΩ=3的不饱和链烃再结合6molH2即达到饱和 |
| B、C10H8的Ω=7 |
| C、C4H8的不饱和度与C3H6、C2H4的不饱和度不相同 |
| D、CH3CH2CH=CH2与环丁烷的不饱和度相同 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、Na2CO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、25℃,pH=7的NH3?H2O和NH4Cl的混合溶液中:c(Cl-)=c(NH4+)>c(H+)=c(OH-) |
| C、CH3COONa溶液中:c(Na+)>c(CH3COO -)>c(H+)>c(OH-) |
| D、NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(CO32-)+c(HCO3-) |
下列说法正确的是( )
| A、用强光照射装满次氯酸的试管(倒置于水槽中),可收集到两种气体 |
| B、向漂白粉中加入稀盐酸可加强漂白效果 |
| C、漂白粉和次氯酸溶液都是纯净物 |
| D、氢气在氯气中燃烧生成白色固体 |
某溶液中可能含有以下6中离子中的几种:NH4+、Al3+、Mg2+、CO32-、Cl-、SO42-,为确认了该溶液的组成,现取300mL溶液分成三等份进行如下实验:
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液充分反应后,最终得到沉淀0.58g,同时收集到气体0.03mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量盐酸酸化的BaCl2溶液,充分反应后得到沉淀6.99g.
由此可知,下列关于原溶液组成的叙述正确的是( )
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液充分反应后,最终得到沉淀0.58g,同时收集到气体0.03mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量盐酸酸化的BaCl2溶液,充分反应后得到沉淀6.99g.
由此可知,下列关于原溶液组成的叙述正确的是( )
| A、CO32-和Cl-一定不存在 |
| B、A13+和NH4+一定存在 |
| C、Mg2+一定存在,Al3+存在可能 |
| D、SO42-的浓度是0.1mol?L-1 |

