题目内容
2.海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法不正确的是( )
| A. | 试剂1可以选用石灰乳 | |
| B. | 从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2=2 Cl-+Br2 | |
| C. | 工业上,电解熔融MgO冶炼金属镁可减小能耗 | |
| D. | 粗盐经提纯后可用于制备氯气、钠等产品 |
分析 海水经提纯可到粗盐,苦卤加入稀硫酸、氯气,发生2Br-+Cl2=2 Cl-+Br2,经富集,可蒸馏分离出溴,分离后的溶液中含有钾离子、镁离子,加入试剂1得到氢氧化镁沉淀,则试剂1可为石灰乳,粗盐经提纯后为重要的工业原料,可用于氯碱工业,可用于钠的冶炼,以此解答该题.
解答 解:A.石灰乳和镁离子反应生成氢氧化镁沉淀,试剂1廉价且原料来源广泛,故A正确;
B.氯气能将溴离子氧化为溴单质,然后采用萃取的方法从溶液中获取溴,反应的离子方程式为:2Br-+Cl2=2 Cl-+Br2,故B正确;
C.氧化镁熔点很高,氯化镁熔点较氧化镁低,电解氧化镁冶炼镁增加成本,所以工业上采用电解熔融氯化镁的方法冶炼镁,故C错误;
D.粗盐经提纯后为重要的工业原料,可用于氯碱工业,可用于钠的冶炼,可用于制备氯气、钠等产品,故D正确.
故选C.
点评 本题考查了海水资源的开发和利用,为高频考点,侧重于学生的分析能力和实验能力的考查,涉及氧化还原反应、除杂、金属的冶炼等知识点,明确物质的性质是解本题关键,知道根据金属活动性强弱选取合适的冶炼方法,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元.硅氧四面体可以用投影图表示成:其中○表示氧原子,中心黑点表示硅原子.硅氧四面体通过不同方式的连接可以组成各种不同的硅酸根离子.试确定在无限长的单链阴离子中(见下图),硅原子与氧原子的个数之比为( )
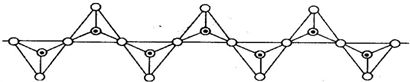

| A. | 1:3 | B. | 1:4 | C. | 2:5 | D. | 2:7 |
13.分子式为C6H12,分子结构中含有3个“CH3”原子团的烯烃共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
10.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2=Na2SO42Na2O2+2SO3=2Na2SO4+O2据此,你认为下列反应方程式中正确的是( )
| A. | 2Na2O2+2 Mn2O7=4Na2MnO4+O2 | B. | Na2O2+2NO2=2NaNO2+O2 | ||
| C. | 2Na2O2+2N2O3=4NaNO2+O2 | D. | 2Na2O2+2N2O4=4NaNO3 |
17.A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略).
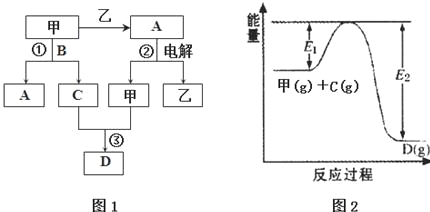
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075 mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如表所示:
①若方程式系数为最简整数比,则该温度下的平衡常数K=20;
填写表中空格:②v正<v逆 ③v正>v逆.

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075 mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如表所示:
| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
填写表中空格:②v正<v逆 ③v正>v逆.
14.将下列物质分别加入到溴水中,溴水中溴单质的物质的量减少的是( )
| A. | KCl | B. | KBr | C. | CCl4 | D. | I2 |
11.下列离子方程式正确的是( )
| A. | 氯化铝溶液中加入过量氨水:A13++4NH3•H2O═4NH4++2H2O+A1O2- | |
| B. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2C12═2Fe3++Br2+4C1- | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2═Fe3++2H2O | |
| D. | 在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O═3H++2Br-+SO42- |
12.下列有关胶体的说法正确的是( )
| A. | 将饱和FeCl3溶液逐滴滴加到NaOH溶液中,即可制得Fe(OH)3胶体 | |
| B. | FeCl3溶液是电中性的,Fe(OH)3胶体是带正电荷的 | |
| C. | 可利用丁达尔现象区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 将500mL 2mol/L FeCl3溶液制成胶体,胶粒的数目为NA |
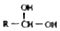 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$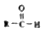 请根据如图回答:
请根据如图回答: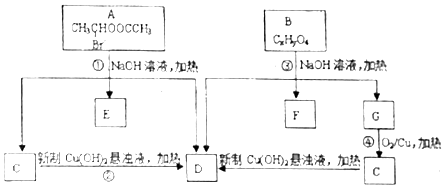
 .
. ;②CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O.
;②CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O.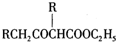 +C2H3OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).
+C2H3OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).