题目内容
18.高铁酸钾(K2FeO4)是一种兼具净水和消毒功能的可溶性盐,可发生如下反应:2K2FeO4+16HCl→4KCl+2FeCl3+8H2O+3Q↑,下列说法不正确的是( )| A. | 可用湿润的淀粉碘化钾试纸检验产物Q | |
| B. | K2FeO4在水中的电离方程式为K2FeO4→2K++Fe6++4O2一 | |
| C. | 反应中氧化剂与还原剂的物质的量之比为1:3 | |
| D. | 反应中涉及的物质中有5种为电解质 |
分析 已知2K2FeO4+16HCl═4KCl+2FeCl3+8H2O+3Q↑,根据元素守恒可知Q为氯气,Fe元素的化合价由+6价降低为+3价,Cl元素的化合价-1价升高为0价,以此来解答
解答 解:A.Q为氯气,可用湿润的淀粉碘化钾试纸检验产物氯气,故A正确;
B.K2FeO4在水中的电离方程式为K2FeO4═2K++FeO42-,故B错误;
C.反应中16molHCl参加反应只有6mol被氧化,则反应中氧化剂与还原剂的物质的量之比为1:3,故C正确;
D.产物Q为氯气,氯气为单质不是电解质,所以反应中涉及的物质中有5种为电解质,故D正确;
故选B.
点评 本题考查氧化还原反应、电解质的概念、物质的检验等,把握反应中元素的化合价变化为解答的关键,考查点较多,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.离子化合物是离子通过离子键结合成的化合物.下列物质属于离子化合物的是( )
| A. | H2O | B. | HCl | C. | NH4Cl | D. | CO2 |
9.能证明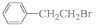 与过量NaOH醇溶液共热时发生了消去反应的是( )
与过量NaOH醇溶液共热时发生了消去反应的是( )
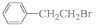 与过量NaOH醇溶液共热时发生了消去反应的是( )
与过量NaOH醇溶液共热时发生了消去反应的是( )| A. | 混合体系$\stackrel{溴水}{→}$Br2的颜色褪去 | |
| B. | 混合体系$\stackrel{足量稀HNO_{3}}{→}$ $\stackrel{AgNO_{3}溶液}{→}$淡黄色沉淀 | |
| C. | 混合体系$\stackrel{提取}{→}$有机物$\stackrel{酸性KMnO_{4}溶液}{→}$紫色褪去 | |
| D. | 混合体系$\stackrel{提取}{→}$有机物$\stackrel{Br_{2}的CCl_{4}溶液}{→}$Br2的颜色褪去 |
6.下列不能用于判断F和Cl的非金属性强弱的事实是( )
| A. | 气态氢化物的稳定性 | B. | 最高价氧化物对应水化物的酸性 | ||
| C. | 单质与氢气反应的难易 | D. | 单质与氢气反应放出热量的多少 |
13.下列实验可达到实验目的是( )
| A. | 用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 | |
| B. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| C. | 用溴的四氯化碳溶液吸收SO2气体 | |
| D. | 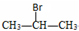 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 |
10.下列对如图两烧杯溶液分析一定正确的是( )


| A. | 甲、乙两烧杯中水电离出OH-浓度:甲<乙 | |
| B. | 分别稀释相同倍数,溶液pH变化:甲=乙 | |
| C. | 相同条件,AgCl(s)在甲中溶解度大于在乙中 | |
| D. | 向乙烧杯加入l0.0mL 0.1mol/L NaOH溶液后一定存在:c(H+)=c(CH3COO-)+c(OH-) |
7.NA代表阿伏伽德罗常数的值,下列说法不正确的是( )
| A. | 过氧化钠与水反应生成2.24 L O2时转移的电子数为0.2NA | |
| B. | 1 L 14 mol/L硝酸与足量铜反应生成气体分子数小于7NA | |
| C. | 1 L1 mol/L NaHS溶液中H2S、HS-和S2-粒子数之和为NA | |
| D. | 1 mol OH-的电子总数比1 mol-OH的电子总数多NA |
8.下列与有机物的结构、性质相关的叙述正确的是( )
| A. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 | |
| B. | 己烷和苯可以用酸性高锰酸钾溶液鉴别 | |
| C. | 甲烷和氯气反应生成一氯甲烷,苯和氢气反应生成环己烷,二者反应类型相同 | |
| D. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ |
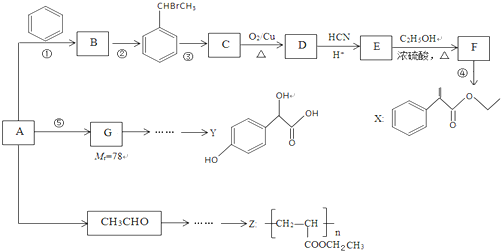
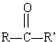 $→_{H+}^{HCN}$
$→_{H+}^{HCN}$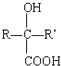 R或R′可以是烃基或氢原子
R或R′可以是烃基或氢原子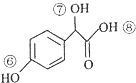 的说法正确的是AD.
的说法正确的是AD. .
.