题目内容
7.分子式为C8H8O2的含有苯环有机物,能与NaHCO3溶液反应生成气体,则符合上述条件的同分异构体(不考虑立体异构)有( )| A. | 4种 | B. | 8种 | C. | 11种 | D. | 12种 |
分析 分子式为C8H8O2的含有苯环有机物,不饱和度为$\frac{2×8+2-8}{2}$=5,能与NaHCO3溶液反应生成气体,含有羧基和苯环,可能含有1个侧链,侧链为-CH2COOH,可能含有2个侧链,侧链为-COOH、-CH3,有邻、间、对三种.
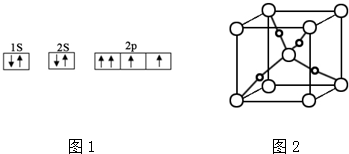
解答 解:分子式为C8H8O2的含有苯环有机物,能与NaHCO3溶液反应生成气体,含有羧基和苯环,可能含有1个侧链,侧链为-CH2COOH,可能含有2个侧链,侧链为-COOH、-CH3,有邻、间、对三种,故符合条件的同分异构体有: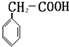 或
或 或
或 或
或 ,共有4种,故选A.
,共有4种,故选A.
点评 本题主要考查了有机物的推断,明确有机物的不饱和度是解本题关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.石油分馏塔装置示意如图.a、b、c分别为石油分馏产品.下列说法正确的是( )

| A. | 在a、b、c三种馏分中,a的熔点最高 | |
| B. | 分馏产品的沸点:a>b>c>柴油>重油 | |
| C. | 在a、b、c三种馏分中,c的平均相对分子质量最大 | |
| D. | a、b、c、柴油、重油都是纯净物 |
15.已知:H2(g)+Br2(l)═2HBr(g)△H=-72kJ/mol,蒸发1molBr2(l)变为1molBr2(g)需吸收30kJ能量.又知:1mol相关分子中的化学键断裂需吸收的能量如下:
则表中a为( )
| H2(g) | Br2(g) | HBr(g) |
| 436kJ | akJ | 369kJ |
| A. | 200 | B. | 230 | C. | 260 | D. | 404 |
2.根据下列各图曲线表征的信息,得出的结论错误的是( )
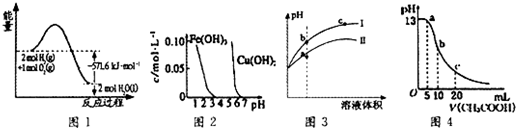

| A. | 图1表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ/mol | |
| B. | 由图2得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 | |
| C. | 图3表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a | |
| D. | 图4表示常温下向体积为10 mL0.1 mol/LNaOH溶液中逐滴加入0.1 mol/LCH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
12.用下列装置进行相应实验,能达到实验目的是( )
| A. | 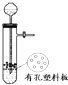 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 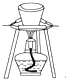 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 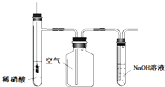 图所示装置用于制备并收集NO气体 图所示装置用于制备并收集NO气体 | |
| D. | 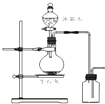 图所示装置制取并收集氨气 图所示装置制取并收集氨气 |
16.如图是部分短周期元素原子半径与原子序数的关系图.字母代表元素,分析正确的是( )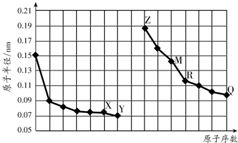

| A. | R在周期表的第15列 | |
| B. | 简单离子的半径:X>Z>M | |
| C. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
17.科学研究与工业生产中常常用到溶液中的反应.
(1)25℃时,0.05mol•L-1Ba(OH)2溶液的pH=13,将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7,则Ba(OH)2溶液与HCl溶液的体积比为1:10.
(2)CO2可转化成有机物实现碳循环:CO2$\stackrel{H_{2}}{→}$CH3OH$\stackrel{O_{2}}{→}$HCOOH…
25℃时,几种酸的电离平衡常数如下:
回答下列问题:
①用离子方程式表示HCOONa溶液呈碱性的原因HCOO-+H2O?HCOOH+OH-.
②物质的量浓度均为0.1mol•L-1的下列四种物质:
a.Na2CO3b.NaClO c.HCOONa d.NaHCO3,pH由大到小的顺序是a>b>d>c(填编号).
(3)常温下,将0.2mol•L-1的HCOOH和0.1mol•L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明所得混合溶液中HCOOH的电离程度大于HCOONa的水解程度(填“大于”“等于”或“小于”).
(4)含有Cr2O的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O72-.为使废水能达标排放,做如下处理:Cr2O${\;}_{7}^{2-}$$→_{H+}^{绿矾}$Cr3+、Fe3+$\stackrel{石灰水}{→}$Cr(OH)3、Fe(OH)3.若处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则残留的Cr3+的浓度为3×10-6mol•L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31).
(1)25℃时,0.05mol•L-1Ba(OH)2溶液的pH=13,将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7,则Ba(OH)2溶液与HCl溶液的体积比为1:10.
(2)CO2可转化成有机物实现碳循环:CO2$\stackrel{H_{2}}{→}$CH3OH$\stackrel{O_{2}}{→}$HCOOH…
25℃时,几种酸的电离平衡常数如下:
| 化学式 | HCOOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①用离子方程式表示HCOONa溶液呈碱性的原因HCOO-+H2O?HCOOH+OH-.
②物质的量浓度均为0.1mol•L-1的下列四种物质:
a.Na2CO3b.NaClO c.HCOONa d.NaHCO3,pH由大到小的顺序是a>b>d>c(填编号).
(3)常温下,将0.2mol•L-1的HCOOH和0.1mol•L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明所得混合溶液中HCOOH的电离程度大于HCOONa的水解程度(填“大于”“等于”或“小于”).
(4)含有Cr2O的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O72-.为使废水能达标排放,做如下处理:Cr2O${\;}_{7}^{2-}$$→_{H+}^{绿矾}$Cr3+、Fe3+$\stackrel{石灰水}{→}$Cr(OH)3、Fe(OH)3.若处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则残留的Cr3+的浓度为3×10-6mol•L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31).