题目内容
2.根据下列各图曲线表征的信息,得出的结论错误的是( )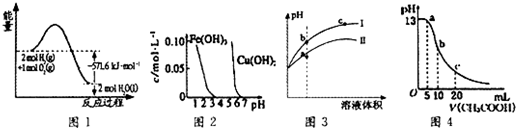
| A. | 图1表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ/mol | |
| B. | 由图2得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 | |
| C. | 图3表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a | |
| D. | 图4表示常温下向体积为10 mL0.1 mol/LNaOH溶液中逐滴加入0.1 mol/LCH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
分析 A.燃烧热是完全燃烧1mol物质生成稳定产物所放出的热量;
B.除去CuSO4溶液中的Fe3+,可以根据铁离子水解平衡的移动知识来判断;
C.稀释pH相同的盐酸和醋酸时,盐酸的pH变化较大,醋酸的pH变化小,溶液的导电能力取决于自由移动离子的浓度的大小;
D.b点体积为10 mL 0.1 mol•L-1NaOH溶液中逐滴加入0.1 mol•L-1 CH3COOH溶液后,所得的溶液是醋酸钠溶液,根据质子守恒来回答.
解答 解:A.根据图1可知,2mol氢气和1mol氧气具有总能量比2mol液态水高571.6kJ,则生成1mol液态水放出285.5kJ热量,则H2的燃烧热为285.8 kJ•mol-1,故A正确;
B.除去CuSO4溶液中的Fe3+,向溶液中加入适量CuO,调节溶液的pH至4左右,铁离子水解完全转化为氢氧化铁铁沉淀,可以除去CuSO4溶液中的Fe3+,故B正确;
C.用水稀释pH相同的盐酸和醋酸,盐酸的pH变化较大,醋酸的pH变化小,溶液的导电能力取决于自由移动离子的浓度的大小,即其中Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a;故C错误;
D.体积为10 mL 0.1 mol•L-1NaOH溶液中逐滴加入0.1 mol•L-1 CH3COOH溶液后,两溶液恰好反应生成醋酸钠,根据质子守恒可得:c(CH3COOH)+c(H+)=c(OH-),故D正确;
故选C.
点评 本题综合考查学生弱电解质的电离平衡、酸的稀释以及燃烧热的判断等方面的知识,属于综合知识的考查,难度中等,注意掌握难溶物溶解平衡及其影响,明确燃烧热的概念,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
9.对于铵盐的描述正确的是( )
①易溶于水
②加热NH4Cl固体制取NH3
③与碱混合后加热都有NH3 放出.
①易溶于水
②加热NH4Cl固体制取NH3
③与碱混合后加热都有NH3 放出.
| A. | ①②③ | B. | ①② | C. | ①③ | D. | ②③ |
10.短周期主族元素A、B、C、D,原子序数依次增大.A、B、C三种元素原子的最外层电子数之和为15,A、C的原子序数的差为8,A原子最外层电子数等于B原子最外层电子数的2倍.下列叙述正确的是( )
| A. | 原子半径:A<D<C<B | |
| B. | 非金属性:C>D | |
| C. | 氢化物的热稳定性:C>A | |
| D. | 单质B常温下能溶于浓硝酸但不能溶于氢氧化钠溶液 |
14.下列微粒电子式错误的是( )
| A. | 氯原子:$\underset{\stackrel{••}{Cl}}{••}$• | B. | 硫离子:$\underset{\stackrel{••}{S}}{••}$:2- | C. | 溴离子[:$\underset{\stackrel{••}{Br}}{••}$:]- | D. | 钙离子Ca2+ |
7.分子式为C8H8O2的含有苯环有机物,能与NaHCO3溶液反应生成气体,则符合上述条件的同分异构体(不考虑立体异构)有( )
| A. | 4种 | B. | 8种 | C. | 11种 | D. | 12种 |
14.煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示.下列说法正确的是( )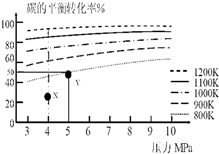

| A. | 上述正反应为吸热反应 | |
| B. | 在5MPa、800K时,该反应的平衡常数为$\frac{{V}^{2}}{{a}^{2}}$L2•mol-2 | |
| C. | 在4MPa、1200K时,图中X点υ(H2)正>υ(H2)逆 | |
| D. | 工业上维持6MPa 1000K而不采用10MPa1000K,主要是因为前者碳的转化率高 |
11.为测定人体血液中Ca2+的含量,设计了如下方案:

有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O若血液样品为15mL,滴定生成的草酸消耗0.001mol•L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为( )

有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O若血液样品为15mL,滴定生成的草酸消耗0.001mol•L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为( )
| A. | 0.002 5 mol•L-1 | B. | 0.001 mol•L-1 | C. | 0.000 3 mol•L-1 | D. | 0.003 5 mol•L-1 |
 氮元素可形成卤化物、叠氮化物及配合物等
氮元素可形成卤化物、叠氮化物及配合物等