题目内容
3.下列说法正确的是(NA表示阿伏伽德罗常数)( )| A. | 1molCu与足量硫反应生成Cu2S,转移的电子数为2NA | |
| B. | 标准状况下,分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| C. | 常温常压下,1.6gCH4中含有的原子总数为5NA | |
| D. | 常温下,1L0.1mol•L-1的NHCl4溶液中NH4+的数目为0.1NA |
分析 A、铜生成Cu2S后,铜元素变为+1价;
B、NO2和CO2中均含2个氧原子;
C、求出甲烷的物质的量,然后根据1mol甲烷中含5mol原子来分析;
D、铵根离子是弱碱阳离子,在溶液中会水解.
解答 解:A、铜生成Cu2S后,铜元素变为+1价,故1mol铜转移1mol电子即NA个,故A错误;
B、NO2和CO2中均含2个氧原子,故NA个混合物分子中含2NA个氧原子,故B正确;
C、1.6g甲烷的物质的量的物质的量为0.1mol,而1mol甲烷中含5mol原子,故0.1mol甲烷中含0.5mol原子即0.5NA个,故C错误;
D、铵根离子是弱碱阳离子,在溶液中会水解,故溶液中的铵根离子的个数小于0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列有关实验的选项正确的是( )
| A. | 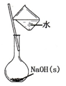 配置0.10mol/LnaOH溶液 | |
| B. | 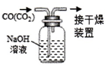 除去CO中的CO2 | |
| C. | 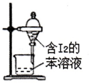 苯萃取碘水中的I2,分出水层后的操作 | |
| D. | 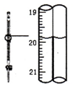 记录滴定终点读数为19.80mL |
11.糖类、油脂和蛋白质是维持人体生命活动所必须的三大营养物质,以下叙述正确的是( )
| A. | 淀粉水解的最终产物是葡萄糖 | |
| B. | 植物油不能使溴的四氯化碳溶液褪色 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
18.下列叙述中正确的是( )
| A. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| B. | 乙烯的结构简式可表示为CH2CH2 | |
| C. | 苯、乙醇和乙酸都可以发生取代反应 | |
| D. | 油脂皂化反应基本完成的现象是反应后静置,反应液分两层 |
15.下列实验不能达到实验目的是( )
| A. |  萃取时振荡分液漏斗 | B. |  电解精炼铜 | ||
| C. |  铝热反应 | D. |  实验室模拟合成氨 |
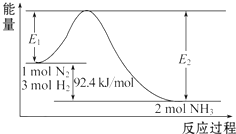 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.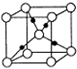 已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族.
已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族. (1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2×10-7mol/Lmol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11mol/Lmol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2×10-7mol/Lmol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11mol/Lmol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).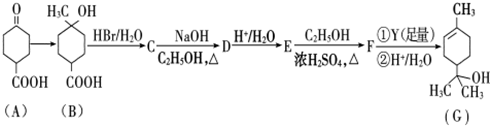
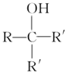
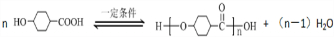 .
.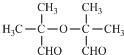 .
.