题目内容
5.用已知物质的量浓度的盐酸滴定待测的氢氧化钠溶液,下列情况会使滴定结果偏高的是( )| A. | 酸式滴定管用水洗净后未用标准液润洗 | |
| B. | 锥形瓶内有水珠未干燥就加入待测的氢氧化钠溶液 | |
| C. | 滴定终点时俯视滴定管读数 | |
| D. | 滴定时溶液刚变成无色就立即停止滴定 |
分析 用已知物质的量浓度的盐酸滴定待测的氢氧化钠溶液,则c(NaOH)=$\frac{c(盐酸)V(盐酸)}{V(NaOH)}$,不当操作导致V(盐酸)偏大,会使滴定结果偏高,以此来解答.
解答 解:A.酸式滴定管用水洗净后未用标准液润洗,消耗V(盐酸)偏大,会使滴定结果偏高,故A选;
B.锥形瓶内有水珠未干燥就加入待测的氢氧化钠溶液,n(NaOH)不变,则对实验无影响,故B不选;
C.滴定终点时俯视滴定管读数,V(盐酸)偏小,则会使滴定结果偏低,故C不选;
D.滴定时溶液刚变成无色就立即停止滴定,没有等到30s内不恢复,V(盐酸)偏小,则会使滴定结果偏低,故D不选;
故选A.
点评 本题考查中和滴定,为高频考点,把握滴定原理、仪器的使用、实验操作为解答的关键,侧重分析与实验能力的考查,注意结合计算式及不当操作分析误差,题目难度不大.

练习册系列答案
相关题目
15.已知反应mX(g)+nY(g)?qZ(g)△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法不正确的是( )
| A. | 通入稀有气体使压强增大,平衡不移动 | |
| B. | 增大压强同时又升高温度,反应速率加快且可以提高Z 的产率 | |
| C. | 降低温度,混合气体的平均相对分子质量变大 | |
| D. | 增加X的物质的量,Y的转化率增大 |
16.有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10mL刻度处,现把管内液体全部流下排出,用量筒接收,所得溶液的体积( )
| A. | 不能确定 | B. | 为40mL | C. | 为10mL | D. | 大于为40mL |
13.已烯雌酚是一种激素类药物,结构如图,下列有关叙述中不正确的是( )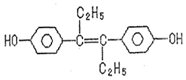

| A. | 可与NaOH和NaHCO3发生反应 | |
| B. | 可以用有机溶剂萃取 | |
| C. | 1mol该有机物可以与5molBr2发生反应 | |
| D. | 该有机物分子中,可能有18个碳原子共平面 |
10.有四种物质的量浓度相同且由一价阳离子A+、B+和一价阴离子X-、Y-组成的盐溶液,常温下AX溶液和BY溶液的pH都为7,AY溶液的pH<7,BX的溶液的pH>7.则可能不水解的盐是( )
| A. | AX | B. | BX | C. | AY | D. | BY |
17.下列溶液中的Cl-浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150mL 2mol•L-1 KClO3溶液 | B. | 75mL 2mol•L-1CaCl2溶液 | ||
| C. | 150mL 2mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
8.在2L密闭容器内,充入0.2mol NO气体和0.1molO2,T℃时下列反应:
2NO(g)+O2(g)═2NO2(g)体系中n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$.该温度下反应的平衡常数K=$\frac{900}{8}$.
已知:K300℃>K350℃,则该反应是放热反应.
(2)达到平衡时v(NO)为2×10-2 mol/(L•s).
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内气体的密度保持不变
e.容器内气体的颜色不再变化
(4)达到平衡时若移走部分NO2,则下列说法正确的是bc.
a.平衡将向正向移动,正反应速率增大,逆反应速率减小
b.重新到达平衡时,NO的平衡转化率将增大,平衡常数不变
c.重新到达平衡时,容器内混合气体的密度较原来减小,压强也减小.
2NO(g)+O2(g)═2NO2(g)体系中n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.09 | 0.08 | 0.08 | 0.08 |
已知:K300℃>K350℃,则该反应是放热反应.
(2)达到平衡时v(NO)为2×10-2 mol/(L•s).
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内气体的密度保持不变
e.容器内气体的颜色不再变化
(4)达到平衡时若移走部分NO2,则下列说法正确的是bc.
a.平衡将向正向移动,正反应速率增大,逆反应速率减小
b.重新到达平衡时,NO的平衡转化率将增大,平衡常数不变
c.重新到达平衡时,容器内混合气体的密度较原来减小,压强也减小.
 .
.