题目内容
16.某学生欲配制3.6mol/L的H2SO4溶液80mL,探究硫酸的性质.实验室有两种不同浓度的硫酸可供选用:①25%的硫酸(ρ=1.18g/mL);②98%的硫酸 (ρ=1.8g/mL).请回答下列问题:(1)配制该硫酸溶液应选用容量瓶的规格为100mL.
(2)本配制实验需所选用硫酸的体积为20.0mL.
(3)取所配硫酸溶液,往其中加入BaCl2溶液,观察有白色沉淀出现.试回答:如何证明溶液中的硫酸根离子沉淀完全?静置,往上层清液中继续加入BaCl2溶液,如无白色沉淀产生,则SO42-已沉淀完全,反之,没有沉淀完全.
(4)将所配稀硫酸逐滴加入到Fe(OH)3胶体中至过量,观察到的现象是先产生红褐色沉淀,然后沉淀溶解,得棕黄色溶液,反应的离子方程式为Fe(OH)3+3H+═Fe3++3H2O.
(5)将标号为②的浓硫酸与等体积水混合,其质量分数大49%(填“大于”、“小于”、“等于”、“无法确定”).
(6)经探究知 Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,试用单线桥法标出该反应中电子转移的方向和数目
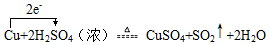 .实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.
.实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.
分析 (1)依据配制溶液体积选择合适规格容量瓶;
(2)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸体积;
(3)依据硫酸根离子能够与钡离子反应生成硫酸钡沉淀解答;
(4)依据胶体的聚沉的性质及氢氧化铁与硫酸酸碱中和反应解答;
(5)根据密度和体积计算溶液的总质量,根据硫酸的密度大于水的密度,判断质量分数关系;
(6)铜失电子数=1(2-0)=2,硫酸得电子数=1(6-4)=2,该反应中转移电子数是2,用单线桥标出该反应电子转移的方向和数目;计算生成二氧化硫的物质的量,依据方程式计算耗氧化剂的物质的量.
解答 解:(1)配制3.6mol/L的H2SO4溶液80mL,应选择100mL容量瓶;
故答案为:100;
(2)选用98%的硫酸 (ρ=1.8g/mL),物质的量浓度C=$\frac{1000×1.8×98%}{98}$=18mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:18mol/L×V=3.6mol/L×100mL,解得V=20.0mL;
故答案为:20.0;
(3)证明溶液中的硫酸根离子沉淀完全,使用操作为:静置,往上层清液中继续加入BaCl2溶液,如无白色沉淀产生,则SO42-已沉淀完全,反之,没有沉淀完全;
故答案为:静置,往上层清液中继续加入BaCl2溶液,如无白色沉淀产生,则SO42-已沉淀完全,反之,没有沉淀完全;
(4)将所配稀硫酸逐滴加入到Fe(OH)3胶体中至过量,硫酸为可溶性电解质,所以能够使氢氧化铁胶体聚成生成红褐色氢氧化铁沉淀,然后氢氧化铁与硫酸发生酸碱中和反应生成硫酸铁和水,离子方程式:Fe(OH)3+3H+═Fe3++3H2O,所以看到现象为:先产生红褐色沉淀,然后沉淀溶解,得棕黄色溶液;
故答案为:Fe(OH)3+3H+═Fe3++3H2O;先产生红褐色沉淀,然后沉淀溶解,得棕黄色溶液;
(5)等体积混合,设体积分别为Vml,98%的H2SO4溶液密度为ρ1,水密度为ρ2,则混合后溶液的质量分数为w(H2SO4)=$\frac{V•{ρ}_{1}×98%}{V•ρ1+V•ρ2}$×100%=$\frac{ρ1×98%}{ρ1+ρ2}$×100%,因硫酸的密度大于水的密度,则ρ1>ρ2,所以=$\frac{ρ1×98%}{ρ1+ρ2}$×100%>49%;
故答案为:大于;
(6)铜失电子数=1(2-0)=2,硫酸得电子数=1(6-4)=2,该反应中转移电子数是2,用单线桥标出该反应电子转移的方向和数目为: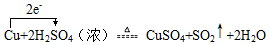 ;
;
标准状况下的SO2气体44.8L,物质的量为$\frac{44.8L}{22.4L/mol}$=2mol;
依据方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,可知参加反应的硫酸有2mol,而只有1mol硫酸中硫元素化合价降低,做氧化剂,则:
Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
2 1
n 2
参加反应的硫酸的物质量为4mol,做氧化剂的为2mol;
故答案为: 2.
2.
点评 本题为综合题考查了一定物质的量浓度溶液配制,胶体的性质,氧化还原反应基本概念判断,熟悉溶液配制原理及氧化还原反应规律是解题关键,题目难度中等.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | CH3COOK的摩尔质量为98 g | |
| C. | 1 mol CH3COOK含有2 mol氧 | |
| D. | 1 molCH3COOK含有3×6.02×1023个氢元素 |
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 向水中加入少量固体HCl气体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)和Kw均不变 |
| A. | 反应放出的热量为0.08akJ | |
| B. | 平衡时H2O的转化率为CO转化率的一半 | |
| C. | 若改变条件,K增大则压强增大 | |
| D. | 将容器的体积压缩为1L,该平衡正向移动 |

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 |
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时(s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=$\frac{0.01}{{t}_{1}}$mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
| A. | 铜丝 | B. | 稀硫酸 | C. | NaCl | D. | CO2 |