题目内容
19.在0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| C. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
分析 A.加水稀释促进醋酸电离;
B.加入少量0.1 mol/L HCl溶液,溶液中c(H+)增大;
C.加入少量NaOH固体,溶液中c(H+)减小;
D.加入少量醋酸钠固体,溶液中c(CH3COO-)增大,平衡逆向移动.
解答 解:A.加水稀释后溶液体积增大,H+、CH3COO-结合机会降低,导致醋酸电离程度增大,平衡正向移动,故A错误;
B.加入少量0.1 mol/L HCl溶液,HCl是强电解质,完全电离,导致溶液中c(H+)增大,平衡逆向移动,故B错误;
C.加入少量NaOH固体,NaOH和氢离子反应导致溶液中c(H+)减小,平衡正向移动,故C正确;
D.加入少量醋酸钠固体,溶液中c(CH3COO-)增大,平衡逆向移动,溶液酸性降低,故D错误;
故选C.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生分析判断能力,明确浓度、温度对弱电解质电离影响原理是解本题关键,注意弱电解质电离程度与浓度关系,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
9.CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H1.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃、500℃的密闭容器中,甲醇的物质的量;图2:温度分别为T1~T5的密闭容器中,反应均进行到5min时甲醇的体积分数).下列叙述正确的是( )
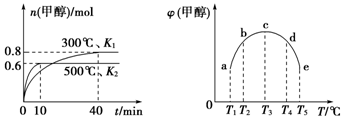

| A. | 该反应的△H1>0,且K1>K2 | |
| B. | 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压 | |
| C. | 300℃时,向平衡后的容器中再充入0.8 mol CO,0.6 mol H2,0.2 mol CH3OH,平衡正向移动 | |
| D. | 500℃时,向平衡后的容器中再充入1 mol CH3OH,重新平衡后,H2浓度和百分含量均增大 |
7.下雪时,常用融雪剂清理路面,醋酸钾( CH3COOK)是效果较好的融雪剂,下列关于1mol CH3COOK的叙述正确的是( )
| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | CH3COOK的摩尔质量为98 g | |
| C. | 1 mol CH3COOK含有2 mol氧 | |
| D. | 1 molCH3COOK含有3×6.02×1023个氢元素 |
4.一定温度下,水存在H 2O?H++OH-△H=Q(Q>0)的平衡,下列叙述一定正确的是( )
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 向水中加入少量固体HCl气体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)和Kw均不变 |
11.在某容积为2L的密闭容器内加入0.2mol的CO和0.1mol的H2O,在催化剂存在的条件下高温加热发生如下反应:CO(g)+H2O(g)=CO2(g)+H2(g)△H=akJ/mol(a>0)达到平衡后测得c(CO):c(CO2)=3:2,下列说法正确的是( )
| A. | 反应放出的热量为0.08akJ | |
| B. | 平衡时H2O的转化率为CO转化率的一半 | |
| C. | 若改变条件,K增大则压强增大 | |
| D. | 将容器的体积压缩为1L,该平衡正向移动 |
5.一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g);△H<0.现将1molA和2molB加入甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 |
