题目内容
3.阅读下列材料后回答问题一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+$?_{②}^{①}$Fe3+的转化时,②中的Fe3+作氧化剂;
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作还原剂,具有还原性;
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分时盐酸)的作用下转化成亚铁盐.离子方程式为Fe+2H+=Fe2++H2↑;
(4)请设计一个实验证明该麦片中含有微量的颗粒细小的还原铁粉取少量麦片于烧杯中加水溶解并过滤,有微量的细小颗能被磁铁吸引.
分析 (1)②中Fe元素的化合价降低;
(2)使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高;
(3)铁粉在人体胃酸的作用下转化成亚铁盐,还生成氢气;
(4)金属铁能被磁铁吸引,可以用来检验金属铁的存在.
解答 解:(1)②中Fe元素的化合价降低,则,②中的Fe3+作氧化剂,故答案为:氧化;
(2)使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高,所以维生素C作还原剂,具有还原性,故答案为:还原;还原;
(3)铁粉在人体胃酸的作用下转化成亚铁盐,还生成氢气,该离子反应为Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑;
(4)证明该麦片中含有微量的颗粒细小的还原铁粉可以:取少量麦片于烧杯中加水溶解并过滤,有微量的细小颗能被磁铁吸引,故答案为:取少量麦片于烧杯中加水溶解并过滤,有微量的细小颗能被磁铁吸引.
点评 本题考查氧化还原反应,为高考常考考点,明确反应中元素的化合价变化是解答的关键,侧重基本概念的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.为了增加汽车轮胎的耐磨性,常在轮胎的橡胶中加入的耐磨物质是( )
| A. | 黏土 | B. | 硫磺粉 | C. | 炭黑 | D. | 草木灰 |
11.在某容积为2L的密闭容器内加入0.2mol的CO和0.1mol的H2O,在催化剂存在的条件下高温加热发生如下反应:CO(g)+H2O(g)=CO2(g)+H2(g)△H=akJ/mol(a>0)达到平衡后测得c(CO):c(CO2)=3:2,下列说法正确的是( )
| A. | 反应放出的热量为0.08akJ | |
| B. | 平衡时H2O的转化率为CO转化率的一半 | |
| C. | 若改变条件,K增大则压强增大 | |
| D. | 将容器的体积压缩为1L,该平衡正向移动 |
5.一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g);△H<0.现将1molA和2molB加入甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 |
12.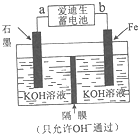 中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
(1)地壳中含量最多的金属元素的单质与氧化铁在高温下发生反应可用于焊接钢轨,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)CO(g)+FeO(s)=CO2(g)+Fe(s)△H=-218.03kJ•mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
则反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的△H=-24.8kJ•mol-1.
(3)在T℃、2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
①反应达到平衡后,再通入一定量的氩气,则CO的转化率将不变(填“增大”、“减小”、“不变”);
②若甲容器中CO的平衡转化率为60%,则T℃时,反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的平衡常数K=64;
③下列说法正确的是B
A.若容器压强恒定,反应达到平衡状态
B.若容器内混合气体密度恒定,反应达到平衡状态
C.甲、乙容器中CO的平衡转化率相等
D.增加Fe2O3粉末的物质的量就能提高CO的转化率
(4)铁与金属镍在碱性条件下可形成二次电池,俗称爱迪生蓄电池.利用爱迪生蓄电池可以制取少量高锰酸钾(装置如图所示),此装置中负极是a(填“a”或“b”),写出阳极的电极反应式Fe-6e-+8OH-=FeO42-+4H2O;当生成19.8g的K2FeO4时,电路中转移的电子的物质的量为0.6mol.
 中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:(1)地壳中含量最多的金属元素的单质与氧化铁在高温下发生反应可用于焊接钢轨,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)CO(g)+FeO(s)=CO2(g)+Fe(s)△H=-218.03kJ•mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
则反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的△H=-24.8kJ•mol-1.
(3)在T℃、2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②若甲容器中CO的平衡转化率为60%,则T℃时,反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的平衡常数K=64;
③下列说法正确的是B
A.若容器压强恒定,反应达到平衡状态
B.若容器内混合气体密度恒定,反应达到平衡状态
C.甲、乙容器中CO的平衡转化率相等
D.增加Fe2O3粉末的物质的量就能提高CO的转化率
(4)铁与金属镍在碱性条件下可形成二次电池,俗称爱迪生蓄电池.利用爱迪生蓄电池可以制取少量高锰酸钾(装置如图所示),此装置中负极是a(填“a”或“b”),写出阳极的电极反应式Fe-6e-+8OH-=FeO42-+4H2O;当生成19.8g的K2FeO4时,电路中转移的电子的物质的量为0.6mol.
10.在可逆反应中,平衡常数与反应进行的限度关系正确的是( )
| A. | K越大,反应程度越大 | B. | K越大,反应程度越小 | ||
| C. | K的大小与反应程度无关 | D. | 升高温度,K增大 |
 综合利用CO2、CO对构建低碳社会有重要意义.
综合利用CO2、CO对构建低碳社会有重要意义.