题目内容
16.有机材料PMMA、新型可降解高分子材料PET、常见解热镇痛药Aspirin的合成路线如下: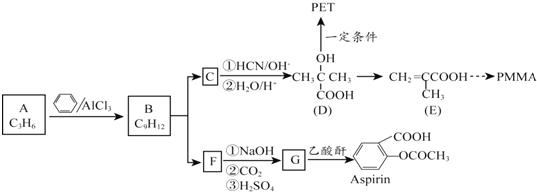
已知:
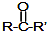 $→_{②H_{2}O/H+}^{①HCN/OH-}$
$→_{②H_{2}O/H+}^{①HCN/OH-}$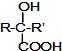
(1)A属于烯烃,其结构简式是CH2=CHCH3.
(2)A与苯在AlCl3催化作用下反应生成B的反应类型是加成反应.
(3)写出B的一溴代物只有2种的芳香烃的名称1,3,5-三甲苯写出生成这两种一溴代物所需要的反应试剂和反应条件Br2/光照和Br2/Fe
(4)B在硫酸催化条件下被氧气氧化可得有机物C与F.
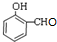
①C由碳、氢、氧三种元素组成,C的结构简式是
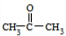 .
.②向少量F溶液中滴加几滴FeCl3溶液,溶液呈紫色,且F在其同系物中相对分子质量最小.G物质中含氧官能团名称为羟基和羧基.
(5)D在一定条件下制取PET的化学方程式是
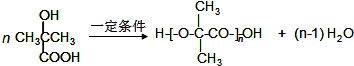 .
.
分析 A属于烯烃,则A结构简式为CH2=CHCH3,根据A、B分子式及苯分子式,可知丙烯与苯发生加成反应生成B,由D的结构简式逆推可知C为 ,则B为
,则B为 ,D发生消去反应生成E,E发生加聚反应生成PMMA为
,D发生消去反应生成E,E发生加聚反应生成PMMA为 ,D发生缩聚反应生成PET为
,D发生缩聚反应生成PET为 .向少量F溶液中加几滴FeCl3溶液,溶液呈紫色,且F在其同系物中相对分子质量最小,则F为
.向少量F溶液中加几滴FeCl3溶液,溶液呈紫色,且F在其同系物中相对分子质量最小,则F为 ,F发生反应生成G,G和乙酸酐发生取代反应生成Aspirin,根据Aspirin结构简式知,G结构简式为
,F发生反应生成G,G和乙酸酐发生取代反应生成Aspirin,根据Aspirin结构简式知,G结构简式为 .
.
解答 解:A属于烯烃,则A结构简式为CH2=CHCH3,根据A、B分子式及苯分子式,可知丙烯与苯发生加成反应生成B,由D的结构简式逆推可知C为 ,则B为
,则B为 ,D发生消去反应生成E,E发生加聚反应生成PMMA为
,D发生消去反应生成E,E发生加聚反应生成PMMA为 ,D发生缩聚反应生成PET为
,D发生缩聚反应生成PET为 .向少量F溶液中滴加几滴FeCl3溶液,溶液呈紫色,且F在其同系物中相对分子质量最小,则F为
.向少量F溶液中滴加几滴FeCl3溶液,溶液呈紫色,且F在其同系物中相对分子质量最小,则F为 ,F发生反应生成G,G和乙酸酐发生取代反应生成Aspirin,根据Aspirin结构简式知,G结构简式为
,F发生反应生成G,G和乙酸酐发生取代反应生成Aspirin,根据Aspirin结构简式知,G结构简式为 .
.
(1)通过以上分析知,A结构简式是CH2=CHCH3,故答案为:CH2=CHCH3;
(2)通过以上分析知,A与苯在AlCl3催化作用下反应生成B的反应类型是加成反应,故答案为:加成反应;
(3)B的一溴代物只有2种的芳香烃为 ,名称是1,3,5-三甲苯,光照条件下发生甲基失去取代反应,催化剂条件下发生苯环上取代反应,需要的试剂与条件:Br2/光照和Br2/Fe
,名称是1,3,5-三甲苯,光照条件下发生甲基失去取代反应,催化剂条件下发生苯环上取代反应,需要的试剂与条件:Br2/光照和Br2/Fe
故答案为:1,3,5-三甲苯;Br2/光照和Br2/Fe;
(4)①通过以上分析知,C的结构简式是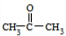 ,故答案为:
,故答案为: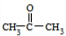 ;
;
②G结构简式为 ,G物质中含氧官能团名称为羟基和羧基,故答案为:羟基和羧基;
,G物质中含氧官能团名称为羟基和羧基,故答案为:羟基和羧基;
(5)D在一定条件下制取PET的化学方程式是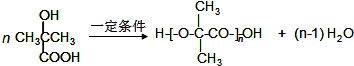 ,
,
故答案为: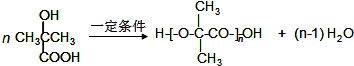 .
.
点评 本题考查有机物推断的与合成,侧重考查学生分析推断能力及获取信息能力,根据某些物质结构简式、反应条件采用正逆结合的方法进行推断,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 当达到化学平衡时,反应物已完全转化为生成物 | |
| B. | 化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏 | |
| C. | 当达到化学平衡时,反应混合物中各成分的浓度相等 | |
| D. | 当达到化学平衡时,正逆反应均已停止 |
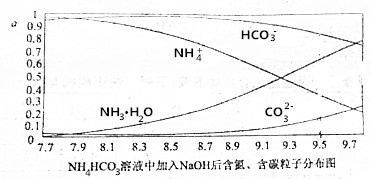
| A. | 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O | |
| B. | 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应 | |
| C. | pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-) | |
| D. | 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3 |
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 熟石膏与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带 | |
| C. | 蚕丝、过氧化氢酶、核酸充分水解后均可得到α氨基酸 | |
| D. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
| A. | 水 | B. | 四氯化碳 | C. | 盐酸 | D. | 硫酸镍溶液 |
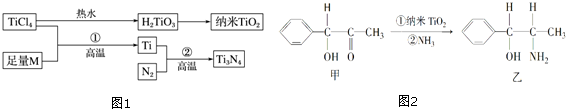
①基态Ti3+中未成对电子数有1个;与Ti同族下一周期元素Zr的基态原子的外围电子排布式为4d25s2;钛元素最高化合价为+4.
②图1中的M是短周期金属元素,M的部分电离能如下表.
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
③纳米TiO2是一种应用广泛的催化剂,某有机反应如图2所示.甲分子中采取sp2杂化的碳原子有7个,乙分子中采取sp3杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%.
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑
、.现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85%的商品磷酸0.49吨.
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式)冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3(均填化学式).
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.
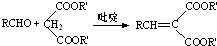 (R,R′,R″表示氢、烷基或芳基)
(R,R′,R″表示氢、烷基或芳基)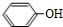 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$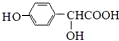 .
. $\stackrel{吡啶}{→}$
$\stackrel{吡啶}{→}$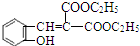 +H2O.
+H2O.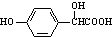 )的同分异构体
)的同分异构体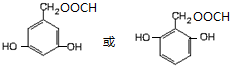 .
.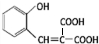 $\stackrel{浓硫酸}{→}$
$\stackrel{浓硫酸}{→}$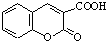 +H2O.
+H2O.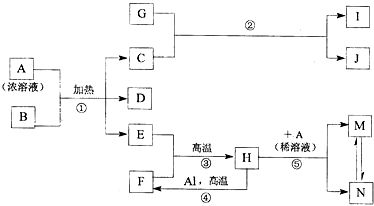
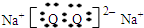 ,化合物J的俗名纯碱.
,化合物J的俗名纯碱.