题目内容
18.已知反应:2A(g)+B(g)?2C(g)△H=-196KJ/mol,某温度下,向一体积为2L的密闭容器中充入0.2molA和0.1molB,5min后达到平衡,共放出热量17.64KJ.下列说法正确的是( )| A. | 5min内用B表示的反应速率为0.018mol/(L•min) | |
| B. | 在该温度下反应的平衡常数为900 | |
| C. | A和B的平衡转化率都为90% | |
| D. | 如果加压,平衡正向移动,可使△H 减小 |
分析 5min后达到平衡,共放出热量17.64kJ,则反应消耗B的物质的量为:$\frac{17.64kJ}{196kJ/mol}$=0.09mol,
2A(g)+B(g)?2C(g)
起始(mol)0.2 0.1 0
转化(mol)0.18 0.09 0.18
平衡(mol)0.02 0.01 0.18
A.根据反应速率v=$\frac{\frac{△n}{V}}{△t}$计算出5min内用B表示的反应速率;
B.分别计算出A、B、C的物质的量,然后带入平衡常数的表达式计算即可;
C.A、B的转化率相等,根据转化率=$\frac{反应消耗的物质的量}{初始物质的量}$×100%计算;
D.化学计量数不变,则焓变值不会发生变化.
解答 解:5min后达到平衡,共放出热量17.64kJ,则反应消耗B的物质的量为:$\frac{17.64kJ}{196kJ/mol}$=0.09mol,
2A(g)+B(g)?2C(g)
起始(mol)0.2 0.1 0
转化(mol)0.18 0.09 0.18
平衡(mol)0.02 0.01 0.18
A.5min内用B表示的反应速率为:$\frac{\frac{0.09mol}{2L}}{5min}$=0.009mol/(L•min),故A错误;
B.平衡时A、B、C的浓度分别为:c(A)=$\frac{0.02mol}{2L}$0.01mol/L、c(B)=$\frac{0.01mol}{2L}$=0.005mol/L、c(C)=$\frac{0.18mol}{2L}$=0.09mol/L,则该温度下该反应的平衡常数=$\frac{0.0{9}^{2}}{0.0{1}^{2}×0.005}$=1800,故B错误;
C.A的转化率为:$\frac{0.18mol}{0.2mol}$×100%=90%,A、B的物质的量之比等于其计量数之比,则二者的转化率相等,都是90%,故C正确;
D.热化学方程式的焓变与化学计量数成正比,加压后平衡正向移动,但是焓变值不变,故D错误;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握三段式在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | 2 mol/L的稀盐酸1L | B. | 73g HCl | ||
| C. | 44.8 L HCl | D. | 1.204×1024个HCl分子 |
| A. | 0.0004mol/(L•min) | B. | 0.0002mol/(L•s) | C. | 0.0016 | D. | 0.012 mol/(L•min) |
 立方烷结构为立方体,其结构简式如图所示,立方烷的六氯代物有( )
立方烷结构为立方体,其结构简式如图所示,立方烷的六氯代物有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2,其部分生产流程如下:
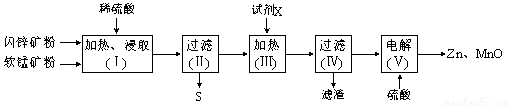
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(1)加热、浸取时所加矿石均需粉碎,其目的是 。
(2)写出FeS和MnO2和稀硫酸反应的离子方程式: 。
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3。pH调节的范围是 ,试剂X可以选用 (填选项字母)。
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3·H2O
(4)电解(Ⅴ)中阳极的电极反应式为 。
(5)Zn和MnO2是制作电池的原料。某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。该电池的正极的电极反应式为 。
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在碱式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从红色变为橙色.
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第③种(填序号).
①2.500mol•L-1 ②0.25mol•L-1 ③0.025mol•L-1
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
(4)用A.偏高;B.偏低;C.无影响;D.无法判断,填写下列各项操作会给实验造成的误差.
①开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出A
②滴定前读数时仰视,滴定完毕读数时俯视B.