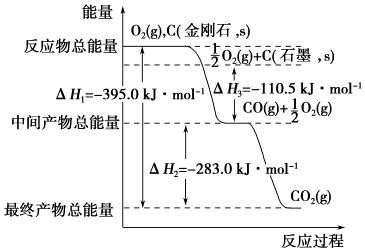
题目内容
10.下列说法正确的是( )| A. | NaOH溶液的导电能力一定比氨水强 | |
| B. | 中和等体积、等物质的量浓度的盐酸和醋酸,需要等量的NaOH | |
| C. | 若盐酸的浓度是醋酸浓度的两倍,则盐酸的c(H+)也是醋酸c(H+)的两倍 | |
| D. | 将NaOH溶液和氨水各稀释一倍,两者的c(OH-)均减小到原来的一半 |
分析 A.导电能力大小与离子浓度有关;
B.盐酸和醋酸的物质的量相等,完全中和消耗等物质的量的氢氧化钠;
C.醋酸与盐酸的电离程度不同;
D.氨水溶液稀释,促进电离.
解答 解:A.氢氧化钠和氨水的浓度未知,不能确定导电能力大小,故A错误;
B.盐酸和醋酸的物质的量相等,完全中和消耗等物质的量的氢氧化钠,故B正确;
C.醋酸与盐酸的电离程度不同,若盐酸的浓度是醋酸浓度的两倍,则盐酸的c(H+)大于醋酸c(H+)的两倍,故C错误;
D.氨水溶液稀释,促进电离,将氨水稀释一倍,c(OH-)大于原来的一半,故D错误.
故选B.
点评 本题考查弱电解质的电离,侧重于学生的分析能力的考查,为高考常见题型,注意把握弱电解质的电离特点以及影响因素,难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
20.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物叙述正确的是( )
| A. | 一个D216O分子所含的中子数为8 | |
| B. | NH4Cl是只含非金属元素的共价化合物 | |
| C. | HCl的电子式为 | |
| D. | H2S不如HF稳定性强 |
18.闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质.软锰矿的主要成分为 MnO2;含少量A12O3和SiO2.现以闪锌矿和软猛矿为原料制备Zn和MnO2,其简化流程如图1(中间产物的固体部分已经略去).
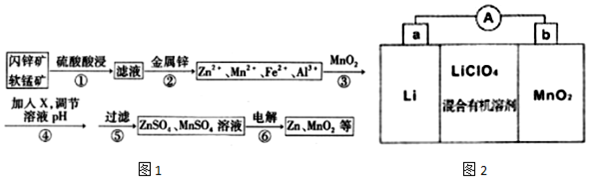
已知:I.矿石中所有金属元素在滤液中均以离子形式存在.
Ⅱ.各种金属离子完全沉淀的pH如表:
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式3MnO2+2FeS+6H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$3MnSO4+Fe2(SO4)3+2S+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是Cu、Cd.
(3)步骤③与MnO2发生氧化还原反应的离子方程式MnO2+2Fe2++4H+=2Fe3++Mn 2++2H2O,物质X可以是BD(用字母表示.
A.Cu2(OH)2CO3 B.MnCO3 C.MgO D.Zn(OH)2
(4)流程中可以循环利用的物质是H2SO4(填化学式).
(5)MnO2与Li构成LiMnO2,该电池反应原理如图2所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
①外电路中的电子移动方向是由a极流向b极(填字母).
②写出该锂离子电池的正极电极反应式MnMnO2+e-+Li+=LiMnO2.
(6)已知:25℃时,HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,该反应的化学方程式为NaCN+H2S=HCN+NaHS.

已知:I.矿石中所有金属元素在滤液中均以离子形式存在.
Ⅱ.各种金属离子完全沉淀的pH如表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式3MnO2+2FeS+6H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$3MnSO4+Fe2(SO4)3+2S+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是Cu、Cd.
(3)步骤③与MnO2发生氧化还原反应的离子方程式MnO2+2Fe2++4H+=2Fe3++Mn 2++2H2O,物质X可以是BD(用字母表示.
A.Cu2(OH)2CO3 B.MnCO3 C.MgO D.Zn(OH)2
(4)流程中可以循环利用的物质是H2SO4(填化学式).
(5)MnO2与Li构成LiMnO2,该电池反应原理如图2所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
①外电路中的电子移动方向是由a极流向b极(填字母).
②写出该锂离子电池的正极电极反应式MnMnO2+e-+Li+=LiMnO2.
(6)已知:25℃时,HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,该反应的化学方程式为NaCN+H2S=HCN+NaHS.
5.下列说法正确的是( )
| A. | 在0.1mol•L-1 Ca(ClO)2溶液中K+、Na+、I-、Cl-可以大量共存 | |
| B. | 氢氧化铁溶于氢碘酸中的离子方程式为:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 等体积和等物质的量浓度的CH3COONH4和NH3•H2O混合液中c(CH3COOH)+c(CH3COO-)═c(NH4+)+c(NH3•H2O) | |
| D. | 常温下,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液显酸性,则:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
15.混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示:
其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液.关于镍氢电池,下列说法不正确的是( )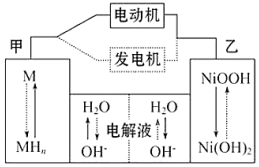
其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液.关于镍氢电池,下列说法不正确的是( )

| A. | 充电时,阴极附近pH降低 | |
| B. | 电动机工作时溶液中OH-向甲移动 | |
| C. | 放电时正极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| D. | 电极总反应式为:MH+NiOOH$?_{充电}^{放电}$M+Ni(OH)2 |
19.下列关于有机化合物的说法正确的是( )
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物数目不相同 | |
| B. | 乙烷,苯,葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 与环己醇(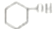 )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) |
20.下列关于有机物的说法正确的是( )
| A. | 糖类、油脂、蛋白质在一定条件下均能水解 | |
| B. | 乙二醇、苯乙烯在一定条件下均可聚合生成高分子化合物 | |
| C. | 分子式为C4H8C12的有机物共有(不含立体异构)8种 | |
| D. |  处于同一平面上的原子数最多为18个 处于同一平面上的原子数最多为18个 |
 反应类型加聚反应
反应类型加聚反应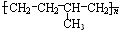 单体结构简式为CH2=CH2和CH3-CH=CH2.
单体结构简式为CH2=CH2和CH3-CH=CH2.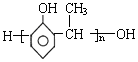 单体结构简式为
单体结构简式为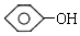 和CH3CHO.
和CH3CHO.