题目内容
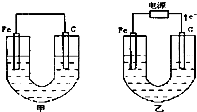 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:(1)若两池中均为Cu(NO3)2溶液,反应一段时间后
①有红色物质析出的是甲池中的
②乙池中阳极的电极反应式是
(2)若两池中均为饱和NaCl溶液
①写出乙池中总反应的离子方程式
②甲池中碳极上电极反应式是
(3)将乙池的电极换成惰性电极,溶液换成AgNO3,当一电极生成标准状况气体22.4升,另一电极质量增加
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,阳极上氢氧根离子放电;
(2)①电解NaCl溶液生成NaOH、氢气、氯气;
②甲中碳为正极,氢氧根离子失去电子,乙中碳为阳极,发生氧化反应;
(3)用惰性电极电解AgNO3溶液时,两极分别生成银和氧气,据电子守恒解答.
(2)①电解NaCl溶液生成NaOH、氢气、氯气;
②甲中碳为正极,氢氧根离子失去电子,乙中碳为阳极,发生氧化反应;
(3)用惰性电极电解AgNO3溶液时,两极分别生成银和氧气,据电子守恒解答.
解答:
解:(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,故答案为:碳;铁;
②乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①电解NaCl溶液生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
②甲中碳为正极,氢氧根离子失去电子,电极反应为4OH--4e-=O2↑+2H2O,乙中碳为阳极,发生氧化反应;
故答案为:4OH--4e-=O2↑+2H2O;氧化反应;
(3)用惰性电极电解AgNO3溶液时,两极分别生成银和氧气,阳极电极反应式为:4OH--4e-=O2↑+2H2O,生成22.4L氧气,转移4mol电子,阴极电极反应式为:Ag++e-=Ag,据电子守恒,生成Ag4mol,阴极增重4mol×108g/mol=432g,故答案为:432.
②乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①电解NaCl溶液生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O
| ||
| ||
②甲中碳为正极,氢氧根离子失去电子,电极反应为4OH--4e-=O2↑+2H2O,乙中碳为阳极,发生氧化反应;
故答案为:4OH--4e-=O2↑+2H2O;氧化反应;
(3)用惰性电极电解AgNO3溶液时,两极分别生成银和氧气,阳极电极反应式为:4OH--4e-=O2↑+2H2O,生成22.4L氧气,转移4mol电子,阴极电极反应式为:Ag++e-=Ag,据电子守恒,生成Ag4mol,阴极增重4mol×108g/mol=432g,故答案为:432.
点评:本题考查原电池和电解原理,明确工作原理及发生的电极反应是解答的关键,注意电极的判断和电子守恒的应用,题目难度中等.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
下列变化中,加入氧化剂可以实现的是( )
| A、Cu2+→Cu |
| B、SO3→SO2 |
| C、NO→NO2 |
| D、Cl2→HCl |
反应NH4HS(s)?NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是( )
| A、温度、容积不变时,通入SO2气体 |
| B、移走一部分NH4HS固体 |
| C、容积不变,充入氨气 |
| D、保持压强不变,充入氮气 |
下列化学用语中正确的是( )
| A、乙烯的结构简式为CH2CH2 |
B、羟基的电子式: |
C、丙烯的键线式: |
| D、乙醇的分子式:CH3CH2OH |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、28g乙烯所含共用电子对数目为4NA |
| B、0.5 mol1,3-丁二烯分子中含有C=C双键数为 NA |
| C、1 mol羟基所含的电子总数为9NA |
| D、标准状况下,11.2 L己烷所含分子数为0.5 NA |
下列说法正确的是( )
| A、H2的摩尔质量是2g |
| B、标准状态下,1molH2O 的体积是22.4L |
| C、氧气的摩尔质量是32g/mol |
| D、2gH2含6.02×1023 个H |
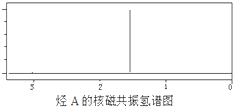 某烃A经李比希元素分析实验测得碳的质量分数为85.71%,该烃的质谱图显示:分子离子峰的最大质荷比为84,该烃的核磁共振氢谱如图所示.红外光谱表明分子中没有碳碳双键,已知烯烃经臭氧作用发生反应:
某烃A经李比希元素分析实验测得碳的质量分数为85.71%,该烃的质谱图显示:分子离子峰的最大质荷比为84,该烃的核磁共振氢谱如图所示.红外光谱表明分子中没有碳碳双键,已知烯烃经臭氧作用发生反应: