题目内容
下列离子或分子组中,在相应的环境中能大量共存的是( )
| 选项 | 环境要求 | 离子 |
| A | 溶液中c(K+)<c(Cl-) | K+、AlO2-、Cl-、NO3- |
| B | 溶液pH>7 | Na+、S2-、K+、ClO- |
| C | 水电离产生的c(H+)=10-12 mol/L的溶液 | ClO-、CO32-、NH4+、NO3-、SO32- |
| D | 向溶液中逐滴滴加烧碱溶液先有沉淀产生,后沉淀消失 | Na+、Al3+、Cl-、SO42- |
| A、A | B、B | C、C | D、D |
考点:离子共存问题
专题:
分析:离子之间反应生成气体、沉淀、弱电解质、络合物或发生双水解、发生氧化还原反应的就不能共存,据此分析解答.
解答:
解:A.溶液中c(K+)<c(Cl-),溶液中还存在阴离子AlO2-、NO3-,根据电荷守恒知,c(H+)>c(OH-),溶液呈酸性,则AlO2-和氢离子反应生成铝离子而不能存在,故A错误;
B.溶液pH>7,溶液呈碱性,但S2-、ClO-发生氧化还原反应而不能共存,故B错误;
C.水电离产生的c(H+)=10-12 mol/L的溶液,溶质抑制水电离,说明溶液呈酸性或碱性,如果呈酸性,ClO-、CO32-、SO32-不能存在,如果呈碱性,则NH4+不能存在,故C错误;
D.向溶液中逐滴滴加烧碱溶液先有沉淀产生,后沉淀消失,Al3+和NaOH反应先生成氢氧化铝沉淀后消失,且这几种离子之间不反应,故D正确;
故选D.
B.溶液pH>7,溶液呈碱性,但S2-、ClO-发生氧化还原反应而不能共存,故B错误;
C.水电离产生的c(H+)=10-12 mol/L的溶液,溶质抑制水电离,说明溶液呈酸性或碱性,如果呈酸性,ClO-、CO32-、SO32-不能存在,如果呈碱性,则NH4+不能存在,故C错误;
D.向溶液中逐滴滴加烧碱溶液先有沉淀产生,后沉淀消失,Al3+和NaOH反应先生成氢氧化铝沉淀后消失,且这几种离子之间不反应,故D正确;
故选D.
点评:本题考查离子共存,明确物质的性质及离子共存的条件是解本题关键,注意题中隐含条件,易错选项是A,要注意根据电荷守恒确定溶液酸碱性,题目难度中等.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
某学生发现他爸爸种植的水稻,生长迟缓,叶色发黄,茎杆不粗硬,易倒伏,学习化学后要他爸爸给水稻追加相应的复合肥料,你认为应选用的复合肥料是( )
| A、KNO3 |
| B、NH4NO3 |
| C、NH4H2PO4 |
| D、K2SO4 |
硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4mol/L,硫酸根离子浓度为0.7mol/L,则K+的物质的量浓度为( )
| A、0.1 mol/L |
| B、0.15 mol/L |
| C、0.3 mol/L |
| D、0.2 mol/L |
在水溶液中能常量共存的一组离子是( )
| A、H+、I-、NO3-、SiO32- |
| B、K+、SO42-、Cu2+、NO3- |
| C、Ag+、Fe3+、Cl-、SO42- |
| D、NH4+、OH-、Cl-、HCO3- |
把0.05molNaOH固体分别加入到100mL液体中,溶液的导电能力变化不大的是( )
| A、自来水 |
| B、0.5mol?L-1醋酸 |
| C、0.5mol?L-1硝酸 |
| D、0.5mol?L-1NaCl溶液 |
能用H++OH-=H2O来表示的化学反应是( )
| A、氢氧化铜和稀盐酸反应 |
| B、氢氧化钡溶液滴入稀硫酸中 |
| C、氢氧化钠溶液与硝酸反应 |
| D、醋酸和氢氧化钾溶液 |
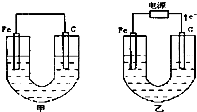 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题: