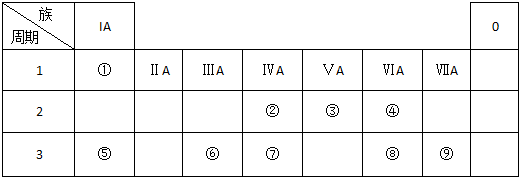
题目内容
28g铜银合金与一定浓度的足量的硝酸反应,放出的气体NO、NO2,再将NO、NO2与标准状况下体积为2.24L的氧气混合后,通入水中充分吸收,恰好被全部吸收,则合金中铜的质量是 g.
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.
解答:
解:铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,n(O2)=
=0.1mol,
设Cu、Ag的物质的量分别为x、y,则:根据质量列方程:x×64g/mol+y×108g/mol=28g,根据电子守恒列方程:2x+1×y=0.1mol×4 则:
解得:
所以m(Cu)=0.1mol×64g/mol=6.4g,
故答案为:6.4.
| 2.24L |
| 22.4L/mol |
设Cu、Ag的物质的量分别为x、y,则:根据质量列方程:x×64g/mol+y×108g/mol=28g,根据电子守恒列方程:2x+1×y=0.1mol×4 则:
|
|
所以m(Cu)=0.1mol×64g/mol=6.4g,
故答案为:6.4.
点评:本题考查混合物计算、氧化还原反应的有关计算,难度中等,根据始态终态法判断金属提供的电子等于氧气获得的电子是关键,注意氧化还原反应中守恒思想的运用.

练习册系列答案
相关题目
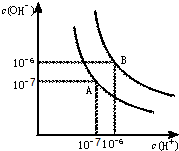 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.