题目内容
某工厂以黄铁矿(主要成分FeS2)为原料生产硫酸设空气中氧气的气体体积分数为0.2,如果该厂生产98%的浓硫酸100t.不考虑其它各生产阶段的物料损失.试完成下列问题:
(1)写出黄铁矿在沸腾炉中燃烧的化学方程式: .
(2)需要含FeS260%的矿石质量是 t.
(3)最少需要消耗空气的体积(标准状况)为多少m3 .
(1)写出黄铁矿在沸腾炉中燃烧的化学方程式:
(2)需要含FeS260%的矿石质量是
(3)最少需要消耗空气的体积(标准状况)为多少m3
考点:化学方程式的有关计算
专题:计算题
分析:(1)黄铁矿在沸腾炉中燃烧生成二氧化硫和氧化铁;
(2)根据S元素守恒,利用H2SO4中硫元素质量分数计算;
(3)根据反应中发生的方程式:4FeS2+11O2
8SO2+2Fe2O3、2SO2+O2
2SO3,计算耗氧量.
(2)根据S元素守恒,利用H2SO4中硫元素质量分数计算;
(3)根据反应中发生的方程式:4FeS2+11O2
| ||
| ||
| △ |
解答:
解:(1)黄铁矿在沸腾炉中燃烧生成二氧化硫和氧化铁,其反应的方程式为:4FeS2+11O2
8SO2+2Fe2O3,
故答案为:4FeS2+11O2
8SO2+2Fe2O3;
(2)根据S元素守恒,结合H2SO4中硫元素质量分数,可知该厂生产98%的硫酸100t,设含FeS260%的矿石质量是xt,
FeS2 ~2SO2 ~2SO3~2H2SO4
120 2×98
60%?x 100t×98%
则
=
,解得x=100,
故答案为:100;
(3)已知反应中发生的方程式:4FeS2+11O2
8SO2+2Fe2O3、2SO2+O2
2SO3,
则 1molFeS2生成2molSO3消耗氧气为(
+1)=3.75mol,
已知m(FeS2)=100t×60%=60t,则n(FeS2)=
=5×105mol,
则n(O2)=5×105mol×3.75=18.75×105mol,
V(O2)=18.75×105mol×22.4L/mol=4.2×107L=4.2×104m3,
所以空气的体积为
=2.1×105m3;
故答案为:2.1×105m3.
| ||
故答案为:4FeS2+11O2
| ||
(2)根据S元素守恒,结合H2SO4中硫元素质量分数,可知该厂生产98%的硫酸100t,设含FeS260%的矿石质量是xt,
FeS2 ~2SO2 ~2SO3~2H2SO4
120 2×98
60%?x 100t×98%
则
| 120 |
| 60%?x |
| 2×98 |
| 100t×98% |
故答案为:100;
(3)已知反应中发生的方程式:4FeS2+11O2
| ||
| ||
| △ |
则 1molFeS2生成2molSO3消耗氧气为(
| 11 |
| 4 |
已知m(FeS2)=100t×60%=60t,则n(FeS2)=
| 60×106g |
| 120g/mol |
则n(O2)=5×105mol×3.75=18.75×105mol,
V(O2)=18.75×105mol×22.4L/mol=4.2×107L=4.2×104m3,
所以空气的体积为
| 4.2×104 |
| 0.2 |
故答案为:2.1×105m3.
点评:本题以硫酸工业为载体,考查根据方程式计算,侧重于考查学生的计算能力,题目难度中等.

练习册系列答案
相关题目
下列化学用语表示正确的是( )
A、二氧化碳  |
B、氮原子的轨道表示式: |
| C、氯离子的最外层电子排布:3s23p6 |
D、硫离子的结构示意图: |
氡(
Rn)可从矿泉水、岩石、地下水、天然气、建筑材料中释放出来,通过呼吸进入人体,停留在呼吸道中,放出α射线,其衰变产物还能放出β、γ射线.这些射线可诱发肺癌.下列关于氡的叙述正确的是( )
222 86 |
| A、Rn的原子核内含有222个中子 |
| B、Rn位于元素周期表中第六周期ⅦA族 |
| C、Rn的化学性质不活泼,因此与任何物质都不能反应 |
| D、新铺大理石地面的居室,需常开窗换气,以减少氡对人体的危害 |
 的名称是
的名称是



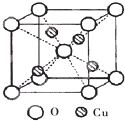 铜是过渡元素.化合物中,铜常呈现+1价或+2价.
铜是过渡元素.化合物中,铜常呈现+1价或+2价.