题目内容
海南省海水资源丰富,天然的海水pH≈8,弱碱性,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.合理利用水资源是持续发展的重要保证.
Ⅰ.火力发电是重要能源,但是烧煤排放的SO2会造成一系列环境问题.利用海水脱硫是一种有效地方法.其工艺流程如图所示:
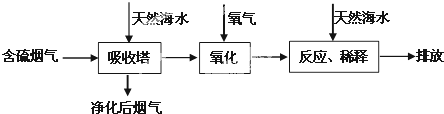
(1)海水淡化是获取淡水资源的有效方法之一,请举出一种常见的海水淡化的方法(任写一个) ;
(2)天然海水吸收含硫烟气后,用氧气进行氧化处理,其原理的化学方程式是 ;氧化后的海水需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 ;
Ⅱ.重金属离子对河流海洋造成严重污染.某化工废水(pH=2.0,d=1g?mL-1)中含有Ag+、Pb2+等重金属离子,其浓度均为0.01mol?L-1,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(3)你认为往废水中加入 (填字母序号),沉淀效果最好.
A.Na2S B.NaOH C.KI D.Ca(OH)2
(4)常温下,如果用生石灰处理上述废水,使溶液的pH=11,处理后废水中c(Pb2+)= .
Ⅰ.火力发电是重要能源,但是烧煤排放的SO2会造成一系列环境问题.利用海水脱硫是一种有效地方法.其工艺流程如图所示:

(1)海水淡化是获取淡水资源的有效方法之一,请举出一种常见的海水淡化的方法(任写一个)
(2)天然海水吸收含硫烟气后,用氧气进行氧化处理,其原理的化学方程式是
Ⅱ.重金属离子对河流海洋造成严重污染.某化工废水(pH=2.0,d=1g?mL-1)中含有Ag+、Pb2+等重金属离子,其浓度均为0.01mol?L-1,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶 电解质 |
AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.Na2S B.NaOH C.KI D.Ca(OH)2
(4)常温下,如果用生石灰处理上述废水,使溶液的pH=11,处理后废水中c(Pb2+)=
考点:海水资源及其综合利用,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论,元素及其化合物
分析:(1)淡化海水就是将海水中的可溶性杂质(氯化钠、氯化镁、氯化钙等)除去的过程,常用方法有蒸馏、离子交换法等;
(2)根据氧气将H2SO3氧化来分析;利用溶液的稀释及酸碱中和反应原理进行分析混合的目的;
(3)溶度积越小越易转化为沉淀,根据表格中的数据进行判断最近试剂;
(4)先计算出溶液中氢氧根离子的物质的量浓度,然后根据Pb(OH)2的溶度积及c(Pb2+)=
进行计算.
(2)根据氧气将H2SO3氧化来分析;利用溶液的稀释及酸碱中和反应原理进行分析混合的目的;
(3)溶度积越小越易转化为沉淀,根据表格中的数据进行判断最近试剂;
(4)先计算出溶液中氢氧根离子的物质的量浓度,然后根据Pb(OH)2的溶度积及c(Pb2+)=
| Ksp |
| c2(OH-) |
解答:
解:(1)因水的沸点较低,可用蒸馏法得到蒸馏水,实现海水淡化的目的,也可以通过离子交换树脂可以除去海水中的离子,从而达到淡化海水的目的,
故答案为:蒸馏法(或离子交换法);
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,氧气将H2SO3氧化为硫酸,该反应为2H2SO3+O2=2H2SO4,氧化后的“海水”需要用大量的天然海水与之混合后才能排放,是因中和、稀释经氧气氧化后海水中生成的酸(H+),
故答案为:2H2SO3+O2═2H2SO4;中和、稀释经氧气氧化后海水中生成的酸;
(3)溶度积越小的越易转化为沉淀,由表格中的数据可知,硫化物的溶度积小,则应选择硫化钠,
故答案为:A;
(4)由Pb(OH)2的溶度积为1.2×10-15,pH=11.0,c(OH-)=10-3mol?L-1,则c(Pb2+)=
=
=1.2×10-9mol?L-1,
故答案为:1.2×10-9mol?L-1 .
故答案为:蒸馏法(或离子交换法);
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,氧气将H2SO3氧化为硫酸,该反应为2H2SO3+O2=2H2SO4,氧化后的“海水”需要用大量的天然海水与之混合后才能排放,是因中和、稀释经氧气氧化后海水中生成的酸(H+),
故答案为:2H2SO3+O2═2H2SO4;中和、稀释经氧气氧化后海水中生成的酸;
(3)溶度积越小的越易转化为沉淀,由表格中的数据可知,硫化物的溶度积小,则应选择硫化钠,
故答案为:A;
(4)由Pb(OH)2的溶度积为1.2×10-15,pH=11.0,c(OH-)=10-3mol?L-1,则c(Pb2+)=
| Ksp |
| c2(OH-) |
| 1.2×10-15 |
| (10-3)2 |
故答案为:1.2×10-9mol?L-1 .
点评:本题考查了海水资源的综合利用、物质的分离与提纯、有关溶度积的计算等知识,注意掌握溶液的稀释、酸碱中和反应原理,能够正确书写常见的氧化还原反应方程式,明确溶度积常数的含有及简单的计算方法,试题综合性较强,侧重分析能力、知识迁移应用能力的考查,题目难度中等.

练习册系列答案
相关题目
Ni、K和F三种元素组成的一个化合物的晶胞如图所示.该化合物的化学式及Ni的配位数为( )


| A、K2NiF4;6 |
| B、K4Ni2F8;8 |
| C、K2NiF3;4 |
| D、K2NiF6;6 |
药物是人们生活的必备品之一,现给出四种药物的主要成分,四种反应均能发生的药物是( )
①酯化反应 ②加成反应 ③水解反应 ④中和反应

①酯化反应 ②加成反应 ③水解反应 ④中和反应

| A、维生素B3 |
| B、阿司匹林 |
| C、芬必得 |
| D、扑热息痛 |
 有一套实验装置,如图所示,可完成高中化学多种实验.装置①②③④中可以装试剂,也可用于气体的收集.
有一套实验装置,如图所示,可完成高中化学多种实验.装置①②③④中可以装试剂,也可用于气体的收集. 的系统命名是:
的系统命名是: