题目内容
3.用Pt电极电解含有Cu2+和X3+各0.1mol的硫酸盐混合溶液(X为金属元素),阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系如图所示.下列说法错误的是( )
| A. | 氧化性由强到弱的顺序:X3+>Cu2+>H+ | |
| B. | 金属X可能为Al | |
| C. | 据图判断,金属X能与稀硫酸反应产生H2 | |
| D. | 通过电子的物质的量大于0.3mol时,发生反应的化学方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
分析 根据图象可知,开始通过0.1moL电子,无固体析出,说明为X3+得电子生成X2+,后再通过0.2mol电子析出固体,则为0.1mol铜离子得电子析出铜,再后来固体不变,则发生的反应为氢离子得电子放出氢气,据此分析解答.
解答 解:开始通过0.1moL电子,无固体析出,说明为X3+得电子生成X2+,所以X不可能为Al,后再通过0.2mol电子析出固体,则为0.1mol铜离子得电子析出铜,当电子超过0.2mol时,固体质量没变,说明这是阴极产生的是氢气,即电解水,说明氧化能力X3+>Cu2+>H+,则X能与稀硫酸反应产生H2,所以ACD错误,B正确,
故选:B.
点评 本题考查学生根据图象获取信息、运用知识综合分析能力,难度中等,关键在确定析出的固体是铜.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.1.92g铜投入一定量的浓HNO3中,铜完全溶解,生成的气体颜色越来越浅,共收集到672mL气体(标况).将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中转变为硝酸,则通入O2的体积(标况)为( )
| A. | 504mL | B. | 168mL | C. | 336mL | D. | 224mL |
11.下列有水参加的反应,其中是氧化还原反应且水既不是氧化剂又不是还原剂的是( )
| A. | 钠跟水 | B. | 氧化钠跟水 | C. | 过氧化钠跟水 | D. | 电解水 |
18.下列说法正确的是( )
| A. | 由不同种类的原子构成的物质不可能是单质 | |
| B. | 葡萄糖注射液不能产生丁达尔现象,不属于胶体 | |
| C. | 蔗糖、硫酸钡和氨气分别属于非电解质、强电解质和弱电解质 | |
| D. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
15. 用以下几种常见有机物填写下列空白:
用以下几种常见有机物填写下列空白:
a.CH4 b.C2H4 c.C6H6 d.C2H5OH e.CH3COOH
(1)等质量的CH4、C2H4、C6H6三种烃完全燃烧消耗O2的量由多到少的顺序是a>b>c(用序号表示).
(2)等物质的量混合的甲烷和乙酸蒸气完全燃烧所得二氧化碳和水蒸气的物质的量之比为3:4.
(3)由乙烯和乙醇蒸气组成的混合气体1mol完全燃烧所需氧气在标准状况下的体积为67.2L.
(4)由两种气态烃组成的混合气体完全燃烧后,将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
根据实验数据填空:
①假设广口瓶里生成一种正盐,其质量为15g.
②混合气体中C、H两元素的物质的量之比为3:8.
③若混合气体是由CH4和C2H4组成,则二者的体积比为1:1.
 用以下几种常见有机物填写下列空白:
用以下几种常见有机物填写下列空白:a.CH4 b.C2H4 c.C6H6 d.C2H5OH e.CH3COOH
(1)等质量的CH4、C2H4、C6H6三种烃完全燃烧消耗O2的量由多到少的顺序是a>b>c(用序号表示).
(2)等物质的量混合的甲烷和乙酸蒸气完全燃烧所得二氧化碳和水蒸气的物质的量之比为3:4.
(3)由乙烯和乙醇蒸气组成的混合气体1mol完全燃烧所需氧气在标准状况下的体积为67.2L.
(4)由两种气态烃组成的混合气体完全燃烧后,将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 104.7g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 318.6g |
①假设广口瓶里生成一种正盐,其质量为15g.
②混合气体中C、H两元素的物质的量之比为3:8.
③若混合气体是由CH4和C2H4组成,则二者的体积比为1:1.
12.下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察如图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的( )

| A. | 甲为小苏打,乙为纯碱 | |
| B. | 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球 | |
| C. | 加热不久就能看到A烧杯的澄清石灰水变浑浊 | |
| D. | 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊 |
13.汽车尾气主要的危害是形成光化学烟雾,危害人类健康.HNCO可用于消除汽车尾气中的NO和NO2,其反应原理为:HNCO+NOx→N2+CO2+H2O,下列说法正确的是( )
| A. | CO2分子中既含有极性键又含有非极性键 | |
| B. | 4.3g HNCO中含有0.1NA个原子 | |
| C. | 反应中NOx是还原剂 | |
| D. | 若NOx中x=2,1mol NO2在反应中转移4NA个电子 |
 人们对苯的认识有一个不断深化的过程.
人们对苯的认识有一个不断深化的过程. 和生石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式:
和生石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式: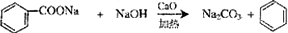 (NaOH参与反应)
(NaOH参与反应)
 )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).