题目内容
13.1.92g铜投入一定量的浓HNO3中,铜完全溶解,生成的气体颜色越来越浅,共收集到672mL气体(标况).将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中转变为硝酸,则通入O2的体积(标况)为( )| A. | 504mL | B. | 168mL | C. | 336mL | D. | 224mL |
分析 根据电子守恒计算,已知HNO3$\stackrel{Cu}{→}$NO、NO2$\stackrel{O_{2}}{→}$HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,以此进行计算.
解答 解:1.92g Cu的物质的量为n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,反应时失去电子数目为2×0.03mol=0.06mol,
由反应整个过程为HNO3$\stackrel{Cu}{→}$NO、NO2$\stackrel{O_{2}}{→}$HNO3可知,
反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,所以消耗氧气的物质的量为n(O2)=$\frac{0.06mol}{4}$=0.015mol,V(O2)=0.015mol×22400mL/mol=336mL,所以通入O2的体积为336mL,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
4.将2molX 和2molY充入2L密闭容器中发生反应:X(g)+3Y(g)?2Z(g)+aQ(g).2min后达到平衡时生成0.8molZ,测得Q的浓度为0.6mol/L,下列叙述错误的是( )
| A. | a的值为3 | B. | 平衡时X的浓度为0.8mol/L | ||
| C. | Y的转化率为60% | D. | 反应速率v(Y)=0.2mol/(L•min) |
1.在密闭容器中A与B反应生成C,其反应速率分别用V(A),V(B),V(C)表示.已知2V(B)=3V(A),3V(C)=2V(B),则此反应可表示为( )
| A. | 2A+3B=2C | B. | A+3B=2C | C. | 3A+B=2C | D. | A+B=C |
8.据报道,8.12天津爆炸事故现场有剧毒物NaCN(氰化钠)库存,在雨天,氰化钠易与空气中的二氧化碳反应生成氰化氢.它也属于剧毒物质,易在空气中弥散,导致次生灾害.下列有关说法中不正确的是( )
| A. | NaCN是钠盐 | B. | 氰化氢的酸性比碳酸的强 | ||
| C. | NaCN是强电解质 | D. | CN-有剧毒性 |
5.下列有关物质的分类合理的是( )
| A. | C60、HD均属于单质 | B. | 漂白粉、明矾均属于混合物 | ||
| C. | 氯化铵、硫酸均属于离子化合物 | D. | SO2、NxOy均属于酸性氧化物 |
3.用Pt电极电解含有Cu2+和X3+各0.1mol的硫酸盐混合溶液(X为金属元素),阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系如图所示.下列说法错误的是( )

| A. | 氧化性由强到弱的顺序:X3+>Cu2+>H+ | |
| B. | 金属X可能为Al | |
| C. | 据图判断,金属X能与稀硫酸反应产生H2 | |
| D. | 通过电子的物质的量大于0.3mol时,发生反应的化学方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
 单体为CH2═CH-Cl.
单体为CH2═CH-Cl. 单体为CH2═CH-CH═CH2,
单体为CH2═CH-CH═CH2, 单体为
单体为 ,
, 单体为HO-CH2CH2-OH和HOOC-COOH.
单体为HO-CH2CH2-OH和HOOC-COOH.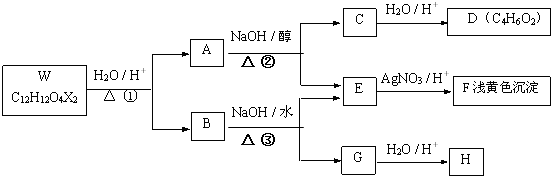

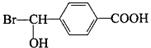
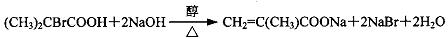
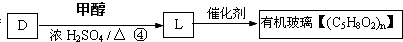 ,反应④的化学方程式是
,反应④的化学方程式是
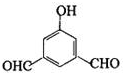 、
、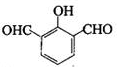 、
、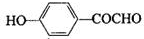 .
.
 、G的结构式为O=C=O;若向M溶液通入G否(是或否)有沉淀,若再通入足量E观察到的现象是有白色沉淀.
、G的结构式为O=C=O;若向M溶液通入G否(是或否)有沉淀,若再通入足量E观察到的现象是有白色沉淀.