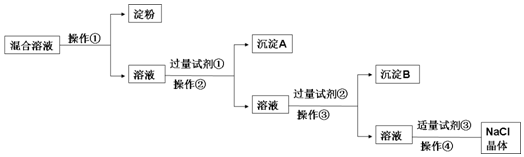
题目内容
1.下列化学反应方程式中,符合“碱性氧化物→碱”转化规律的是( )| A. | MgO+H2SO4═MgSO4+H2O | B. | Na2O+H2O═2NaOH | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | SO3+H2O═H2SO4 |
分析 与酸反应生成盐和水的氧化物为碱性氧化物,碱性氧化物→碱的转化是碱性氧化物溶于水生成碱,据此分析判断.
解答 解:A.MgO+H2SO4═MgSO4+H2O是碱性氧化物和酸反应生成盐,不是碱性氧化物→碱转化,故A错误;
B.Na2O+H2O═2NaOH是碱性氧化物→碱转化,故B正确;
C.无碱性氧化物反应,是金属单质与酸的置换反应,故C错误;
D.三氧化硫是酸性氧化物溶于水生成对应酸,故D错误;
故选B.
点评 本题考查了物质分类、物质组成、物质性质的分析,掌握概念实质和物质性质是解题关键,题目难度不大.

练习册系列答案
相关题目
12.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为890.3kJ.mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ.mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则CO2(g)═2CO(g)+O2(g)的反应热△H=+2×283.0 kJ/mol | |
| C. | NaOH和HCl反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{550℃,30Mpa}^{催化剂}$2NH3(g)△H=-38.6kJ/mol |
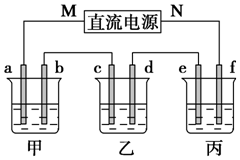 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.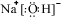 ,并指出其中存在的化学键.离子键和共价键
,并指出其中存在的化学键.离子键和共价键