题目内容
溴水和氯化铁溶液均是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.在探究铁的化合物相互转化时,进行下列实验.
实验操作:向足量20mL的FeSO4溶液中,滴入几滴浓溴水,振荡.
实验现象:溶液由浅绿色变成黄色.
(1)对该实验现象的解释:
①如果发生了化学反应,则使溶液呈黄色的微粒是 (填化学式,下同);
②如果未发生化学反应,则使溶液呈黄色的微粒是 .
(2)通过进一步实验,可证明Br2水和FeSO4溶液是否发生反应.下列是设计的一些实验方案和预测.请填空:
①方案1是否合理? (填“合理”或“不合理”).
方案2中,由于存在反应 (用离子方程式表示),所以预测结论不正确.
②请你另外设计一个合理方案,证明已经反应.将有关内容填入下表.
实验操作:向足量20mL的FeSO4溶液中,滴入几滴浓溴水,振荡.
实验现象:溶液由浅绿色变成黄色.
(1)对该实验现象的解释:
①如果发生了化学反应,则使溶液呈黄色的微粒是
②如果未发生化学反应,则使溶液呈黄色的微粒是
(2)通过进一步实验,可证明Br2水和FeSO4溶液是否发生反应.下列是设计的一些实验方案和预测.请填空:
| 操作 | 预期现象及结论 | |
| 方案1 | 取少量黄色溶液,加入NaOH溶液 | 如果生成红褐色沉淀,则说明发生了反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 如果溶液变蓝色,则说明未发生反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 如果下层溶液呈橙红色,则说明: |
方案2中,由于存在反应
②请你另外设计一个合理方案,证明已经反应.将有关内容填入下表.
| 实验操作 | 预期现象及结论 | 解释现象的离子方程式 |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)加入溴水的溶液,溴单质浓度较小时,溶液呈黄色;Fe3+的溶液呈黄色,所以溶液颜色改变的原因可能为溴单质的颜色、或三价铁离子的颜色或二者混合形成的颜色;
(2)①氢氧化钠与亚铁离子反应生成的氢氧化亚铁不稳定,很容易被氧化成红褐色氢氧化铁沉淀;
方案2中铁离子具有氧化性,能够氧化碘离子,溶液变蓝色,无法说明未发生反应;
②如果亚铁离子被氧化,则溶液中存在铁离子,可以通过具有铁离子的方法判断反应已经进行.
(2)①氢氧化钠与亚铁离子反应生成的氢氧化亚铁不稳定,很容易被氧化成红褐色氢氧化铁沉淀;
方案2中铁离子具有氧化性,能够氧化碘离子,溶液变蓝色,无法说明未发生反应;
②如果亚铁离子被氧化,则溶液中存在铁离子,可以通过具有铁离子的方法判断反应已经进行.
解答:
解:(1)①Fe3+的溶液呈黄色,亚铁离子具有较强还原性,加入溴水后如果发生了化学反应,则使溶液呈黄色的微粒可能为Fe3+,故答案为:Fe3+;
②溴单质浓度较小时,溶液呈黄色,如果未发生化学反应,则使溶液呈黄色的微粒是Br2,故答案为:Br2;
(2)①取少量黄色溶液,加入NaO最终生成红褐色沉淀,不一定说明溴水和FeSO4溶液发生了化学反应,因为氢氧化钠和亚铁离子反应生成的氢氧化亚铁白色沉淀会迅速变为灰绿色最后生成红褐色沉淀氢氧化铁,所以不合理;
取少量黄色溶液,加入淀粉碘化钾溶液,溶液变蓝色,不一定说明未发生化学反应,因为溴单质与亚铁离子反应生成的Fe3+会氧化碘离子,反应生成单质碘,发生反应的方程式为:2Fe3++2I-═2Fe2++I2,
故答案为:不合理;2Fe3++2I-═2Fe2++I2;
②判断溴水和FeSO4溶液是否反应的最简单方法是只需检验有无三价铁离子生成就可以证明发生反应,方法为:取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+,
故答案为:
.
②溴单质浓度较小时,溶液呈黄色,如果未发生化学反应,则使溶液呈黄色的微粒是Br2,故答案为:Br2;
(2)①取少量黄色溶液,加入NaO最终生成红褐色沉淀,不一定说明溴水和FeSO4溶液发生了化学反应,因为氢氧化钠和亚铁离子反应生成的氢氧化亚铁白色沉淀会迅速变为灰绿色最后生成红褐色沉淀氢氧化铁,所以不合理;
取少量黄色溶液,加入淀粉碘化钾溶液,溶液变蓝色,不一定说明未发生化学反应,因为溴单质与亚铁离子反应生成的Fe3+会氧化碘离子,反应生成单质碘,发生反应的方程式为:2Fe3++2I-═2Fe2++I2,
故答案为:不合理;2Fe3++2I-═2Fe2++I2;
②判断溴水和FeSO4溶液是否反应的最简单方法是只需检验有无三价铁离子生成就可以证明发生反应,方法为:取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+,
故答案为:
| 实验操作 | 预期现象及结论 | 解释现象的离子方程式 |
| 取少量黄色溶液,滴加KSCN溶液 | 溶液变为红色,则说明发生了反应 | Fe3++3SCN-=Fe(SCN)3 |
点评:本题考查了性质实验方案的设计,题目难度中等,涉及了离子的检验方法分析、实验现象的判断应用等知识,明确常见离子的检验方法及实验方案的设计原则为解答本题的关键,试题培养了学生的分析、理解能力.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
几难溶物质的有关数值如表所示:下列关于含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法正确的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-36 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A、向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀 |
| B、该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 |
| C、当pH=10时,溶液中c(Fe2+):c(Fe3+)=2×1020:1 |
| D、向该溶液中加入适量氨,调节pH到9.6后过滤,将所得的沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
下列说法正确的是( )
| A、准状况下,1 mol任何物质体积均为22.4L |
| B、2g H2含1mol H |
| C、氧气的摩尔质量是32 g/mol |
| D、3.01×1023个SO2分子的质量为64g |
分类法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是( )
| A、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| B、根据水溶液是否导电,将物质分为电解质和非电解质 |
| C、根据是否含氧元素,将物质分为氧化剂和还原剂 |
| D、根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 |
下列图示与对应的叙述相符的是( )
A、 如图表示盐酸滴加到0.1mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
B、 如图表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 |
C、 如图表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
D、 如图表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |

 表示(其中X、Y均不为氢):写出符合上述通式且能发生银镜反应的四种物质的结构简式
表示(其中X、Y均不为氢):写出符合上述通式且能发生银镜反应的四种物质的结构简式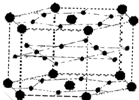 A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.基态时,A、B原子核外电子均成对,且核电荷数A>B,原子半径A<B;C与A在周期表属于同一区的元素,原子半径接近.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F在周期表中属于同一区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E的逐级电离能数据有两次突跃,E原子的第一电离能至第四电离能(kJ/mol)分别为:578、1817、2745、11575;F原子有三个能层,E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答:
A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.基态时,A、B原子核外电子均成对,且核电荷数A>B,原子半径A<B;C与A在周期表属于同一区的元素,原子半径接近.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F在周期表中属于同一区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E的逐级电离能数据有两次突跃,E原子的第一电离能至第四电离能(kJ/mol)分别为:578、1817、2745、11575;F原子有三个能层,E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答: