题目内容
16.下列溶液中,C1-的物质的量浓度最大的是( )| A. | 300 mL0.1 mol/L NaCl溶液 | |
| B. | 100 mL0.1 mol/LFeCl3溶液 | |
| C. | 标准状况下,4.48LHC1气体溶于水配成的1 L溶液 | |
| D. | 向1 L0.2 mol/L BaCl2溶液中加入0.2 mol/L的H2SO4溶液到沉淀恰好完全时的溶液(忽略溶液混合时的体积变化) |
分析 根据溶液中C(Cl-)=溶质的物质的量浓度×化学式中氯离子个数,与溶液的体积无关.据此分析.
解答 解:A、300 mL0.1 mol/L NaCl溶液中氯离子的浓度c=0.1mol/L×1=0.1mol/L;
B、100 mL0.1 mol/LFeCl3溶液中氯离子浓度c=0.1mol/L×3=0.3mol/L;
C、标况下4.48LHCl的物质的量为0.2mol,溶于水配制成1L溶液后,所得盐酸溶液的浓度c=$\frac{n}{V}$=$\frac{0.2mol}{1L}$=0.2mol/L,溶液中氯离子浓度c=0.2mol/L×1=0.2mol/L;
D、设反应消耗的硫酸溶液的体积为VL,生成的HCl的物质的量为xmol,根据BaCl2和H2SO4的反应的化学方程式BaCl2+H2SO4=BaSO4+2HCl可知:
BaCl2 +H2SO4 =BaSO4 +2HCl
1 1 2
0.2mol 0.2mol/L×VL xmol
则有:$\frac{1}{0.2mol}=\frac{1}{0.2Vmol}=\frac{2}{xmol}$
解得V=1L x=0.4mol
即溶液中的氯离子的物质的量为0.4mol,则浓度c=$\frac{0.4mol}{2L}$=0.2mol/L.
故选B.
点评 本题考查了物质的量浓度的有关计算,根据溶液中C(Cl-)=溶质的物质的量浓度×化学式中氯离子个数来解答即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列叙述正确的是( )
| A. | 硝酸具有还原性 | B. | 光导纤维的主要成分是二氧化硅 | ||
| C. | 次氯酸是一种强酸 | D. | 钠的焰色为浅紫色 |
7.已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)某温度时,Kap=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7mol/L,则该溶液呈碱性.
(2)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
①上述盐溶液中的阴离子,结合质子(H+)能力最强的是CO32-
②根据表中数据判断,浓度均为0.01mol•L-1的下列五种物质的溶液中,酸性最强的是D;将各溶液分别稀释100倍,pH变化最小的是A(填编号).
A.HCN B.HClO C.C6H5OH D.CH3COOH
③据表数据,请计算0.1mol/L的NaCN溶液中水电离出的氢氧根离子浓度1.0×10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡移动原理解释其原因因为CO32-会结合反应Cl2+H2O?H++Cl-+HClO生成的H+,使平衡向右移动(写离子方程式并用必要的文字说明)
(3)在0.1mol/L的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
(1)某温度时,Kap=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7mol/L,则该溶液呈碱性.
(2)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
②根据表中数据判断,浓度均为0.01mol•L-1的下列五种物质的溶液中,酸性最强的是D;将各溶液分别稀释100倍,pH变化最小的是A(填编号).
A.HCN B.HClO C.C6H5OH D.CH3COOH
③据表数据,请计算0.1mol/L的NaCN溶液中水电离出的氢氧根离子浓度1.0×10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡移动原理解释其原因因为CO32-会结合反应Cl2+H2O?H++Cl-+HClO生成的H+,使平衡向右移动(写离子方程式并用必要的文字说明)
(3)在0.1mol/L的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
4.下列离子方程式表达不正确的是( )
| A. | Na2SO3溶液使酸性高锰酸钾溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O | |
| B. | 铵明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca 2++2HCO 3 -+2OH -=BaCO 3↓+CO 3 2- 十2H 2 O | |
| D. | 弱酸尼泊金酸( 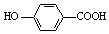 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: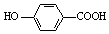 +HCO3-→ +HCO3-→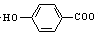 -+CO2↑+H2O -+CO2↑+H2O |
6.为了除去工业微量的Br2中微量的Cl2,可向工业Br2中( )
| A. | 通入HBr | B. | 加入NaCO3溶液 | C. | 加入NaBr | D. | 加入Na2SO3溶液 |
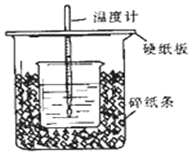 ①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称环形玻璃搅拌棒,另一处错误是小烧杯口和大烧杯口没有平齐.
①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称环形玻璃搅拌棒,另一处错误是小烧杯口和大烧杯口没有平齐.
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: