题目内容
18.下列关于有机物的说法中,正确的是( )| A. | 乙醇和乙酸分子中均含有一OH,均可与NaOH反应 | |
| B. | 甲烷和乙烯均能使酸性的高锰酸钾溶液褪色 | |
| C. | 苯分子是一种单双键交替排列的特殊结构,所以既可发生取代又能加成反应 | |
| D. | 煤和石油均为混合物 |
分析 A.乙醇为中性物质;
B.甲烷与高锰酸钾不反应;
C.苯易取代难加成,但苯中不含双键;
D.煤和石油均为多种物质组成的混合物.
解答 解:A.乙醇为中性物质,则乙酸与NaOH反应,故A错误;
B.甲烷与高锰酸钾不反应,而乙烯能使酸性的高锰酸钾溶液褪色,故B错误;
C.苯易取代难加成,但苯中不含双键,苯中化学键为介于单键与双键之间特殊的化学键,故C错误;
D.煤和石油均为多种物质组成的混合物,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质,题目难度不大.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
8.下列有关实验操作的说法错误的是( )
| A. | 中和滴定盛待测液的锥形瓶中有少量水对滴定结果无影响,锥形瓶不能用待测液润洗 | |
| B. | 酸式和碱式滴定管用蒸馏水洗净后还需用标准液或待测液润洗 | |
| C. | 滴定时左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管的液面 | |
| D. | 称量氯化钠固体,氯化钠放在称量纸上,置于托盘天平的左盘,砝码放在天平的右盘 |
9.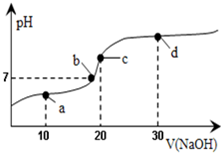 20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )
20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )
 20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )
20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )| A. | a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B. | b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | ||
| C. | c点:c(H+)=c(CH3COOH)+c(OH-) | D. | d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
6. 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.
(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)═ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2 时的反应热△H=-158kJ/mol.
(4)该同学用如图装置进行实验,分析影响反应速率的因素.实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如表所示:
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)═ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2 时的反应热△H=-158kJ/mol.
(4)该同学用如图装置进行实验,分析影响反应速率的因素.实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
13.下列四个反应中,水起的作用与其它反应不同的是( )
| A. | NO2+H2O | B. | Cl2+H2O | C. | Na+H2O | D. | SO2+H2O |
3.下列溶液:①pH=0的盐酸;②0.5mol/L的盐酸溶液;③0.1mol/L的氯化铵溶液;④0.1mol/L的氢氧化钠溶液;⑤0.1mol/L的氟化钠溶液,由水电离的c(H+)由大到小的顺序正确的是( )
| A. | ①②③④⑤ | B. | ③⑤④②① | C. | ①②③⑤④ | D. | ⑤③④①② |
10.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| B. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| C. | 常温常压下,23 g NO2含有NA个氧原子 | |
| D. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 |
7.二元酸H2A在水中发生电离:H2A═H++HA-和HA-?H++A2-,则下列几种物质的水溶液中关系式不正确的是( )
| A. | NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+) | B. | NaHA:c(Na+)=c(A2-)+c(HA-) | ||
| C. | Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+) | D. | H2A:c(H+)=c(HA-)+2c(A2-)+c(OH-) |
8.下列是某同学对相应反应的离子方程式所作的评价,其中对应评价合理的是( )
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 把MgSO4溶液滴入Ba(OH)2溶液 | Mg2++2OH-═Mg(OH)2↓ | 正确 |
| B | 氧化铜与稀盐酸反应 | CuO+2H+ $\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2O | 正确 |
| C | 向FeCl2溶液中通入氯气 | Fe2++Cl2═Fe3++2Cl- | 正确 |
| D | AlCl3溶液中加足量氨水 | Al3++3OH-═Al(OH)3↓ | 正确 |
| A. | A | B. | B | C. | C | D. | D |