题目内容
10.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.| 实 验 目 的 | 试剂及方法 |
| 证明NaOH溶液具有碱性 | B |
| 鉴别Na2SO4溶液和(NH4)2SO4溶液 | D |
| 检验自来水中是否含有Cl2 | C |
| 区别CH4和C2H4两种无色气体 | A |
A、酸性高锰酸钾,观察现象 B、滴加酚酞试液,观察现象
C、用淀粉碘化钾试纸,观察现象 D、加入NaOH浓溶液加热,观察现象.
分析 酚酞遇到NaOH溶液变红;Na2SO4溶液和(NH4)2SO4溶液中阳离子不同,铵根离子与碱反应生成氨气;氯气可氧化KI生成碘,淀粉遇碘变蓝;乙烯能被高锰酸钾氧化,而甲烷不能,以此来解答.
解答 解:酚酞遇到NaOH溶液变红,则证明NaOH溶液具有碱性,可滴加酚酞试液,观察现象,即选B;
Na2SO4溶液和(NH4)2SO4溶液中阳离子不同,铵根离子与碱反应生成氨气,则鉴别实验方法为加入NaOH浓溶液加热,观察现象,即选D;
氯气可氧化KI生成碘,淀粉遇碘变蓝,则检验自来水中是否含有Cl2,方法为用淀粉碘化钾试纸,观察现象,即选C;
乙烯能被高锰酸钾氧化,而甲烷不能,则区别CH4和C2H4两种无色气体的实验方法为加入酸性高锰酸钾,观察现象,即选A,
故答案为:B;D;C;A.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
1.下列化合物中,同时含有离子键、非极性共价键的是( )
| A. | NaOH | B. | H2O2 | C. | Na2O2 | D. | NaCl |
5.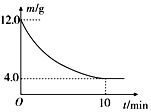 在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )
在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )
 在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )
在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )| A. | 升高温度时,正反应速率增大,逆反应速率减小 | |
| B. | 随着反应的进行,混合气体的平均相对分子质量增大 | |
| C. | 增加硫酸镁的质量时,正反应速率将增大 | |
| D. | 在 0~10min内,v(CO)=0.01mol?L-1?min-1 |
15.下列反应中,既属于氧化还原反应且为放热反应的是( )
| A. | 氢氧化钾与硫酸的反应 | |
| B. | 金属镁与盐酸的反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl固体的反应 |
2.下列表达方式错误的是( )
| A. | 氟化钠的电子式为  | B. | 氯原子的结构示意图: | ||
| C. | CO2分子的结构式:O=C=O | D. | 甲烷的电子式  |
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-lKNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+,Na+、SO42- | |
| C. | 0.1 mol•L-1 FeCl3溶液:K+、NH4+、Cl-、S2- | |
| D. | 在无色透明溶液中:Ba2+、Ca2+、NO3-、Cl- |
 ;
; 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验
