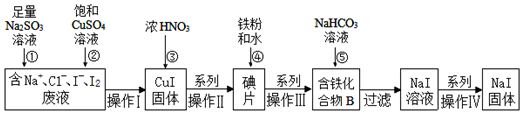
题目内容
3.已知水的离子积在不同温度下分别为:KW(25℃)=1.0×10-14 mol2•L-2,KW(35℃)=2.1×10-14 mol2•L-2,则下列关于水的叙述正确的是( )| A. | 水电离的[H+]随着温度的升高而降低 | B. | 在35℃时,水电离的[H+]>[OH-] | ||
| C. | 水的电离程度:35℃>25℃ | D. | 水电离的[OH-]随温度升高而增大 |
分析 根据题干知,升高温度水的离子积常数增大,说明升高温度促进水电离,水的电离程度增大,但溶液中仍然存在[H+]=[OH-],以此解答该题.
解答 解:A.升高温度促进水电离,所以[H+]随着温度的升高而增大,故A错误;
B.升高温度促进水电离,但溶液中仍然存在[H+]=[OH-],溶液仍然呈中性,故B错误;
C.升高温度促进水电离,则水的电离程度增大,所以水的电离程度:35℃>25℃,故C正确;
D.水的电离为吸热过程,升高温度,平衡向吸热反应方向移动,[OH-]随温度升高而增大,故D正确.
故选CD.
点评 本题以离子积常数为载体考查水的电离,为高频考点,侧重考查学生的分析能力,明确温度与水的离子积常数关系是解本题关键,注意离子积常数只与温度有关,与溶液酸碱性无关,易错选项是B.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
14.下列离子方程式正确的是( )
| A. | 氯气和水发生反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 用NaOH溶液除去铝表面的氧化膜时产生气泡:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ | |
| C. | 金属钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 将铁粉加入稀硫酸和硝酸钾混合溶液中,铁粉溶解:Fe+2H+=Fe2++H2↑ |
11.下列离子方程式对应的化学方程式正确的是( )
| A. | H++OH-═H2O CH3COOH+NaOH═CH3COONa+H2O | |
| B. | Ba2++SO42-═BaSO4↓ Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | CO32-+2H+═CO2↑+H2O CaCO3+2HCl═CaCl2+CO2↑+H2O | |
| D. | Al(OH)3+OH-═AlO2-+2H2O Al(OH)3+NaOH═NaAlO2+2H2O |
18.用pH试纸测量碱溶液的pH时,若事先将pH试纸用蒸馏水润湿,则测量结果会( )
| A. | 偏大 | B. | 偏小 | C. | 不变 | D. | 无法判断 |
8.下列各组中两种溶液间的反应,不能用同一离子方程式来表示的是( )
| A. | HCl+Na2CO3;H2SO4+K2CO3 | B. | Fe+HCl;Fe+H2SO4 | ||
| C. | BaCl2+Na2SO4;Ba(OH)2+(NH4)2SO4 | D. | KOH+CH3COONH4;Ba(OH)2+NH4Cl |
13.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | pH<7的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| C. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、ClO-、Cl- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |

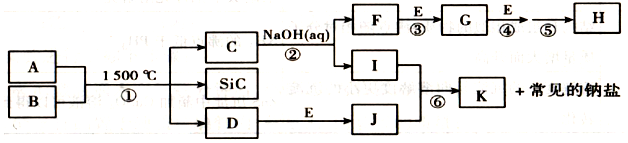
 ,G的化学式:NO;
,G的化学式:NO;