题目内容
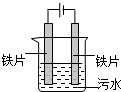 电浮选凝聚法处理污水的原理如图所示.电解过程生成的胶体能使污水中的悬浮物凝聚成团而除去,电解时阳极也会产生少量气体.下列说法正确的是( )
电浮选凝聚法处理污水的原理如图所示.电解过程生成的胶体能使污水中的悬浮物凝聚成团而除去,电解时阳极也会产生少量气体.下列说法正确的是( )| A、可以用铝片或铜片代替铁片 |
| B、阳极产生的气体可能是O2 |
| C、电解过程中H+向阳极移动 |
| D、若污水导电能力较弱,可加入足量硫酸 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.氢氧化铜不能形成胶体;
B.阳极上可能氢氧根离子放电;
C.电解过程中,阳离子向阴极移动;
D.保持污水的pH在5.0~6.0之间能产生胶体.
B.阳极上可能氢氧根离子放电;
C.电解过程中,阳离子向阴极移动;
D.保持污水的pH在5.0~6.0之间能产生胶体.
解答:
解:A.铜作阳极上生成铜离子,铜离子和氢氧根离子生成氢氧化铜沉淀而不能生成胶体,所以不能吸附悬浮物,故A错误;
B.阳极上氢氧根离子放电生成氧气,故B正确;
C.电解过程中,H+向阴极移动,故C错误;
D.保持污水的pH在5.0~6.0之间能产生胶体,强酸性条件下不能产生胶体,故D错误;
故选B.
B.阳极上氢氧根离子放电生成氧气,故B正确;
C.电解过程中,H+向阴极移动,故C错误;
D.保持污水的pH在5.0~6.0之间能产生胶体,强酸性条件下不能产生胶体,故D错误;
故选B.
点评:本题以电浮选凝聚法为载体考查了电解池原理,根据胶体的吸附性、产生胶体溶液的酸碱性结合离子移动方向来分析解答,易错选项是D,为了加强溶液的导电性,可以加入食盐.

练习册系列答案
相关题目
2.7g铝粉分别与体积均为100mL、浓度均为2mol/L的(1)硫酸溶液、(2)烧碱溶液、(3)盐酸完全反应,放出氢气的体积关系(相同条件)是( )
| A、(1)=(2)=(3) |
| B、(1)=(2)>(3) |
| C、(1)>(2)>(3) |
| D、(2)>(1)=(3) |
下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A、Cu2+、NH4+、Br-、OH- |
| B、Ag+、NO3-、Cl-、K+ |
| C、K+、Ba2+、OH-、SO42- |
| D、H+、NO3-、Fe2+、Na+ |
电池在生产、生活中应用越来越广泛.下列说法错误的是( )
| A、化学电源有一次电池、可充电电池和燃料电池等,一次电池只能放电,不能充电 |
| B、铅蓄电池应用广泛,主要优点是单位重量的电极材料释放的电能大 |
| C、燃料电池具有能量利用率高、可连续使用和污染轻等优点 |
| D、锂电池是一种高能电池,体积小、重量轻,单位质量能量比高 |
下列各组中的离子,能在溶液中大量共存的是( )
| A、Ba2+、Na+、Cl-、SO42- |
| B、Ag+、Al3+、NO3-、H+ |
| C、Na+、HCO3-、Cl-、OH- |
| D、K+、H+、SO42-、OH- |
下列反应的离子方程式书写正确的是( )
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
| C、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| D、铜和浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
 氧化还原反应在生产、生活中具有广泛的用途.
氧化还原反应在生产、生活中具有广泛的用途.