题目内容
1.密闭容器中进行可逆反应:CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达到平衡后,只改变其中一个条件,对平衡的影响是:(1)升高温度,平衡向逆反应方向移动(填“向正反应方向”“向逆反应方向”“不移动”下同);
(2)容器体积不变,若通入CO2气体,平衡向逆反应方向移动,反应混合物的颜色变深;(填“变深”、“变浅”、“不变”下同)
(3)缩小容器体积,平衡不移动,反应混合物的颜色变深;
(4)加入催化剂,平衡不移动.
分析 (1)升高温度,平衡吸热反应方向移动;
(2)容器体积不变,若通入CO2气体,增强生成物的浓度,平衡逆向移动,二氧化氮的浓度变大,反应混合物的颜色变深;
(3)缩小容器体积,相当于增大压强;
(4)加入催化剂,正逆反应速率同等程度加快.
解答 解:(1)正反应是放热反应,升高温度,平衡向逆反应方向移动,故答案为:向逆反应方向;
(2)容器体积不变,若通入CO2气体,平增强生成物的浓度,平衡逆向移动,二氧化氮的浓度变大,反应混合物的颜色变深,故答案为:向逆反应方向;变深;
(3)缩小容器体积,相当于增大压强,两边计量数相等,所以平衡不移动,反应混合物的颜色变深,故答案为:不;变深;
(4)加入催化剂,正逆反应速率同等程度加快,所以加入催化剂,平衡不移动,故答案为:不.
点评 本题考查化学平衡的影响因素,题目难度不大,解答时首先分析化学方程式的特征,特别是反应前后气体的化学计量数关系以及反应的吸、放热问题.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
6.下列有关性质的比较中,不正确的是( )
| A. | 金属原子化热:Na<Mg<Al | B. | 晶格能:NaBr<NaCl<MgO | ||
| C. | 键的极性:N-H<O-H<F-H | D. | 熔点: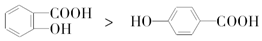 |
12.向含有1.17g NaCl和1.17g NaF的溶液中,加入过量的AgNO3溶液,将析出的沉淀过滤、洗涤、干燥后称其质量为2.87g.根据此实验确定AgF在水中的溶解性应为( )
| A. | 易溶于水 | B. | 此AgCl更难溶于水 | ||
| C. | 与AgCl一样难溶于水 | D. | 无法确定溶解性 |
9.T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g),反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2,Y的百分含量与时间的关系如图2所示.下列分析不正确的是( )
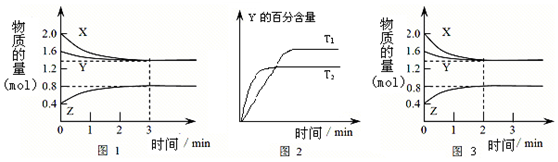

| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 0~3min内,v(X)=0.1 mol/(L•min) | |
| C. | 达平衡后,升高温度,v正、v逆都增大,且再次平衡前v正<v逆 | |
| D. | 若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
16.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol/L的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、[Al(OH)4]-、CO32- |
6.下列离方方程式书写正确的是( )
| A. | 铁与醋酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 硫酸铜溶液与氢氢化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| C. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 碳酸氢钙与盐酸反应:HCO3-+H+═H2O+CO2↑ |
13.在某无色透明的酸性溶液中,能大量共存的离子组是( )
| A. | Na+、NO3-、Mg2+、OH- | B. | MnO4-、K+、CO32-、Na+ | ||
| C. | K+、SO42-、HCO3-、Na+ | D. | NH4+、SO42-、K+、Cl- |
11.室温时下列溶液中的粒子浓度关系正确的是( )
| A. | 相同物质的量浓度的溶液:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3•H2O中,c(NH4)由大到小的顺序是:①>③>②>④ | |
| B. | 将等体积的盐酸和氨水混合后pH=7:c(NH4+)>c(Cl-) | |
| C. | 0.1 mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-)+c(Cl-) |