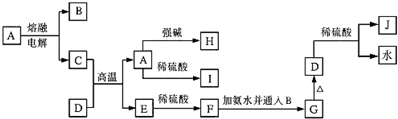
题目内容
16.设NA代表阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,18gH218O所含质子数为10NA | |
| B. | 1mol的-OH与1mol的OH-所含电子数均为10NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为6NA | |
| D. | Na2O2的反应中,每生成0.1molO2,转移电子数目为0.4NA |
分析 A.质量转化为物质的量,结合1个H218O含有10个质子解答;
B.1个氢氧根离子含有9个电子,1个氢氧根离子含有10个电子;
C.烯烃中极性键为碳氢键,乙烯和丁烯的最简式为CH2,根据最简式计算出混合物中含有碳氢键数目;
D.Na2O2与水、二氧化碳、酸等反应生成氧气中,过氧化钠既是氧化剂又是还原剂.
解答 解:A.18gH218O物质的量=$\frac{18g}{20g/mol}$=0.9mol,含质子数为9NA,故A错误;
B.1mol的-OH含电子数均为9NA与1mol的OH-所含电子数为10NA,故B错误;
C.A.42g乙烯和丁烯的混合物中含有3mol最简式CH2,含有6mol氢原子,烯烃中极性键为碳氢键,6mol氢原子形成了6mol碳氢极性键,所以混合气体中含有极性键数为6NA,故C正确;
D.Na2O2与水、二氧化碳、酸等反应生成氧气中,过氧化钠既是氧化剂又是还原剂,生成1mol氧气,转移2mol电子,所以每生成0.1molO2,转移电子数目为0.2NA,故D错误;
故选:C.
点评 本题考查了阿伏加德罗常数的计算及应用,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意过氧化钠的结构及其在反应表现的性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.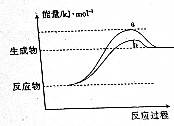 在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:
在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:
(1)反应历程由a变为b的原因可能是使用催化剂.
(2)不同温度下N2的转化率如图:
则a1<(填“>”、“<”或“=”)α2
(3)598K时,向容积为1L的某恒容密闭容器中加入2mol N2、6mol H2O(g)及固体催化剂,使之反应,平衡时容器内的压强为起始时的93.75%.
①达到平衡时,N2的转化率为50%.
②598K时上述固氮反应的平衡常数K=$\frac{2}{27}$.
 在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:
在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:(1)反应历程由a变为b的原因可能是使用催化剂.
(2)不同温度下N2的转化率如图:
| 温度/K | N2的转化率 |
| 598 | a1 |
| 898 | a2 |
(3)598K时,向容积为1L的某恒容密闭容器中加入2mol N2、6mol H2O(g)及固体催化剂,使之反应,平衡时容器内的压强为起始时的93.75%.
①达到平衡时,N2的转化率为50%.
②598K时上述固氮反应的平衡常数K=$\frac{2}{27}$.
11.某无色气体,可以使湿润的蓝色石蕊试纸变红,通入澄清石灰水中,石灰水变浑浊,接着又变澄清,将燃着的蜡烛放入盛有该气体的集气瓶中蜡烛熄灭,则该气体( )
| A. | 一定是CO2 | B. | 一定是SO2 | ||
| C. | 可能是CO2或SO2 | D. | 一定是CO2和SO2混合气体 |
9.海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法不正确的是( )
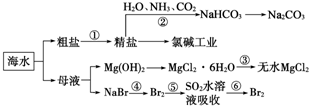

| A. | 过程①中除去粗盐中的SO${\;}_{4}^{2-}$、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 过程②中应先通入NH3再通入CO2气体 | |
| C. | 过程③中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| D. | 从第⑤~⑥步的目的是浓缩、富集溴单质 |
6.下列离子检验的正确的是( )
| A. | 某溶液中滴入稀盐酸,生成无色气体,说明原溶液中有一定有CO32- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ | |
| C. | 加入硝酸银溶液有白色沉淀产生,则一定有Cl- | |
| D. | 分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 |