题目内容
(18分)氯气在科技、生产中应用广泛。
(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是___ 。
(2)实验室用MnO2与浓盐酸反应制取氯气的过程中,可用NaOH溶液吸收尾气,下列试剂也可用于吸收氯气的是____(填字母)。
a.KI溶液 b.FeCl2溶液 c.KCl溶液
写出你选择的一种吸收试剂与Cl2反应的离子方程式:____ 。
也可用浓氨水吸收氯气,同时生成一种无污染的气体,反应的化学方程式是____ 。
(3)以粗盐为原料制备亚氯酸钠(NaClO2)的工艺流程如下

写出二氧化氯发生器中生成二氧化氯的离子方程式 。
(4)FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

a.检验装置的气密性;
b.通入干燥的Cl2,赶尽装置中的空气;
c.用酒精灯在铁屑下方加热至反应完成;
d.在沉积的FeCl3固体下方加热
e.体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
①装置D中FeCl2的作用是 ,写出检验FeCl3的离子方程式 。
②画出尾气吸收装置E并注明试剂。
③该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,FeCl3与H2S反应的离子方程式为________________ 。
(1)2Cl2 + Ca(OH)2 ==CaCl2 + Ca(ClO)2 +2H2O (2分)(2)ab (2分) Cl2 +2I- == 2Cl- + I2 或2Fe2+ + Cl2 ===2Fe3+ + 2Cl- (2分)3 Cl2 + 8NH3 == 6NH4Cl + N2 或 3Cl2 + 2NH3 == 6 HCl + N2 (2分)(3)2ClO3- + SO2 == 2ClO2 + SO42- (2分)(4)①吸收Cl2 (2分) Fe3+ + 3OH- == Fe(OH)3 ↓ 或 Fe3+ + 3SCN- == Fe(SCN)3 (2分)
②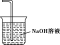 (2分) ③2Fe3++H2S===2Fe2++S↓+2H+ (2分)
(2分) ③2Fe3++H2S===2Fe2++S↓+2H+ (2分)
【解析】
试题分析:(1)熟石灰主要成分是Ca(OH)2,和氯气反应制取漂白粉,那么化学方程式是2Cl2 + Ca(OH)2 ==CaCl2 + Ca(ClO)2 +2H2O (2)利用Cl2有强氧化性也可以选用有还原性物质来吸收Cl2,A、B两种试剂都有还原性都可以吸收Cl2,任选一种物质写出它与Cl2反应的离子方程式,浓氨水吸收氯气,同时生成一种无污染的气体,根据参与反应的物质的原子种类,可以推出该气体是N2,根据两边原子种类和个数相同推出另一种产物是HCl,写出方程式3Cl2 + 2NH3 == 6 HCl + N2,如果NH3过量,NH3 与HCl生成NH4Cl则为3 Cl2 + 8NH3 == 6NH4Cl + N2(3)从流程图中可以看出是利用氯酸钠、二氧化、硫硫酸反应来制取二氧化氯,氯酸钠到二氧化氯,氯的化合价降低,所以发生了氧化还原反应,离子方程式为:2ClO3- + SO2 == 2ClO2 + SO42-(4)①根据实验的信息,FeCl3在B中冷凝变成了固体,进入到D、E装置主要是Cl2 、FeCl2溶液可以与Cl2反应,所以起到吸收Cl2所用,Fe3+的检验通常用KSCN溶液或者NaOH溶液,任选一个写出其离子方程式。② 尾气主要是Cl2有毒需要吸收通常用NaOH溶液来吸收,将Cl2通入到NaOH溶液中即可。 ③FeCl3溶液吸收H2S是利用了氧化还原反应,离子方程式为2Fe3++H2S===2Fe2++S↓+2H+
考点:常见的实验装置各部分的作用、氧化还原反应。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案

 Z(g)
Z(g)