题目内容
5.常温下,一定量冰醋酸加水稀释过程中,溶液的导电性如下图所示.下列说法正确的是( )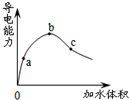
| A. | pH值:b>a>c | |
| B. | 与锌反应起始速率:a=b=c | |
| C. | 水电离的c(H+) c>a>b | |
| D. | 加入足量的NaHCO3固体,产生气体体积:a>b>c |
分析 A.导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
B.与锌反应起始速率与溶液中的氢离子溶液有关,氢离子溶液越大,反应速率越快,结合A的分析答题;
C.在ab段溶液中,醋酸的电离度在增大,氢离子浓度增大,水的电离程度减小,bc段溶液中,醋酸的电离度在增大,溶液酸性减弱,水的电离度在增大;
D.一定量冰醋酸加水稀释,在稀释过程中加入足量的NaHCO3固体,产生气体体积不变.
解答 解:A.导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为b<c<a,故A错误;
B.与锌反应起始速率与溶液中的氢离子溶液有关,氢离子溶液越大,反应速率越快,结合A的分析可知,导电能力越强,离子浓度越大,所以反应速率不可能相等,故B错误;
C.在ab段溶液中,醋酸的电离度在增大,氢离子浓度增大,水的电离程度减小,bc段溶液中,醋酸的电离度在增大,溶液酸性减弱,水的电离度在增大,a点的导电能力小于c点,说明a点中水的电离程度小于c点,所以水电离的c(H+) c>a>b,故C正确;
D.一定量冰醋酸加水稀释,在稀释过程中加入足量的NaHCO3固体,产生气体体积不变,即a=b=c,故D错误;
故选C.
点评 本题考查电解质的电离,题目难度中等,本题注意分析图象,把握弱电解质的电离特征,易错点为C,注意氢离子浓度越大,其溶液的pH越小.

练习册系列答案
相关题目
15.下列关于铁、铜元素的描述中,正确的是( )
| A. | 两元素均位于元素周期表中第4周期Ⅷ族 | |
| B. | 两者均能被潮湿空气腐蚀 | |
| C. | 氧化性:Cu2+>Fe3+>Fe2+ | |
| D. | 铁丝和铜丝在氯气里燃烧均生成二价氯化物 |
13.向明矾KAl(SO4)2.12H2O溶液里滴入Ba(OH)2溶液,当SO42-恰好完全沉淀时,其中元素的存在形式为( )
| A. | 全部形成AlO2- | B. | 全都为Al(OH)3 | ||
| C. | 一部分为Al(OH)3,一部分为Al3+ | D. | 一部分为Al(OH)3,一部分为AlO2- |
20.鉴别乙烯、一氧化碳和氢气三种无色气体的方法,是将它们分别( )
| A. | 先后通入溴水和澄清石灰水 | |
| B. | 点燃后罩上涂有澄清石灰水的烧杯,通入溴水 | |
| C. | 点燃后罩上干燥的冷烧杯 | |
| D. | 点燃后罩上涂有澄清石灰水的烧杯 |
10.下列反应的离子方程式中,不正确的是( )
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe3++Cu | |
| B. | NaHSO4溶液与氢氧化钠溶液反应:OH-+H+═H2O | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CaCO3+2H+═H2O+CO2↑+Ca2+ |
17.FeCl3、CuCl2的混合溶液中加入一定量的铁粉,充分反应后固体完全溶解,则下列判断正确的是( )
| A. | 溶液中一定含Cu2+和Fe2+ | B. | 溶液中一定含Cu2+和Fe3+ | ||
| C. | 溶液中一定含 Fe3+和Fe2+ | D. | 溶液中一定含Fe3+、Cu2+和Fe2+ |
14.如图为某种乙醇燃料电池示意图,工作时电子流方向如图所示,下列判断正确的是( ) 

| A. | X为氧气 | |
| B. | 电极A反应式:CH3CH2OH-12e-+3H2O═2CO2+12H+ | |
| C. | 电极材料活泼性:A>B | |
| D. | B电极附近溶液pH增大 |
 图中A为淡黄色固体,B、C为溶液,D为气体,E、F为白色沉淀.
图中A为淡黄色固体,B、C为溶液,D为气体,E、F为白色沉淀.