题目内容
5.下列各项内容中,排列顺序正确的是( )①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②物质的熔点Li>Na>K
③微粒半径:K+>S2->F-
④单质的密度Na<K<Rb
⑤氢化物的沸点:H2Se>H2S>H2O.
| A. | ①③⑤ | B. | ①②④ | C. | ④⑤ | D. | ①② |
分析 ①碳酸钠加热不分解,碳酸钙高温分解,碳酸氢钠受热易分解;
②碱金属单质,金属原子半径大的熔点低;
③电子层越多,原子半径越大;具有相同排布的离子,原子序数大的离子半径小;
④碱金属单质随原子序数的增大,密度增大,但Na>K;
⑤水中含氢键,沸点最高,相对分子质量大的分子沸点高.
解答 解:①碳酸钠加热不分解,碳酸钙高温分解,碳酸氢钠受热易分解,则热稳定性:Na2CO3>CaCO3>NaHCO3,故正确;
②碱金属单质,金属原子半径大的熔点低,则熔点Li>Na>K,故正确;
③电子层越多,原子半径越大;具有相同排布的离子,原子序数大的离子半径小,则离子半径为S2->K+>F-,故错误;
④碱金属单质随原子序数的增大,密度增大,但Na>K,则密度为K<Na<Rb,故错误;
⑤水中含氢键,沸点最高,相对分子质量大的分子沸点高,则沸点为H2O>H2Se>H2S,故错误;
故选D.
点评 本题考查周期表和周期律,为高频考点,把握元素的性质及周期律为解答的关键,侧重分析与应用能力的考查,注意短周期元素的性质比较及规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
16.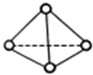 科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断裂1mol键N≡N吸收946kJ热量,则下列叙述中正确的是( )
科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断裂1mol键N≡N吸收946kJ热量,则下列叙述中正确的是( )
 科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断裂1mol键N≡N吸收946kJ热量,则下列叙述中正确的是( )
科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断裂1mol键N≡N吸收946kJ热量,则下列叙述中正确的是( )| A. | 1molN4气体转化为N2时要吸收206 kJ能量 | |
| B. | N4是一种比N2更稳定的分子 | |
| C. | 1molN4气体转化为N2时要放出740 kJ能量 | |
| D. | N4与N2之间不是同素异形体关系 |
20.硫代硫酸钠溶液与稀硫酸的反应方程式为:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,分别进行了四组实验,数据记录如下,出现沉淀所需时间最短的是( )
| 温度(℃) | Na2S2O3溶液 | H2SO4溶液 | H2O的体积 | 出现沉淀所需时间 | |||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| A | 0 | 5mL | 0.1mol/L | 10mL | 0.1mol/L | 5mL | |
| B | 0 | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | |
| C | 30 | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | |
| D | 30 | 5mL | 0.1mol/L | 10mL | 0.1mol/L | 5mL | |
| A. | A | B. | B | C. | C | D. | D |
10.短周期元素A、B、C、D、E、F的原子序数依次增大,其元素特征信息如下表:
(1)F的简单离子的结构示意图为 ;
;
(2)E在周期表中的位置为第三周期ⅢA族;
(3)C和D简单离子的半径大小为O2->Na+;(用离子符号和“>”、“=”或“<”表示)
(4)元素非金属性强弱比较有很多方法,其中C和F的非金属性强弱的研究方案中不可行的是bc(填序号);
a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)A、C、D三种元素组成的化合物中含有的化学键为共价键.
| 元素编号 | 元素特征信息 |
| A | 阳离子核外无电子 |
| B | 最高正价和最低负价的绝对值之差为2 |
| C | 最外层电子数是内层电子数的3倍 |
| D | 1molD单质能与冷水反应,在标准状况下生成11.2LH2 |
| E | 原子最外层电子数等于其周期序数 |
| F | 负二价阴离子的电子层结构与Ar原子相同 |
 ;
;(2)E在周期表中的位置为第三周期ⅢA族;
(3)C和D简单离子的半径大小为O2->Na+;(用离子符号和“>”、“=”或“<”表示)
(4)元素非金属性强弱比较有很多方法,其中C和F的非金属性强弱的研究方案中不可行的是bc(填序号);
a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)A、C、D三种元素组成的化合物中含有的化学键为共价键.
17.下列说法不正确的是( )


| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔沸点由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 沸点由高到低:HI>HBr>HCl>HF | |
| D. | 硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为MgB2 |
14.下列说法不正确的是( )
| A. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| B. | 构成单质分子的粒子之间不一定存在共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 阴、阳离子间通过离子键一定能形成离子化合物 |
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
 . (加聚反应)
. (加聚反应) . (取代反应)
. (取代反应)