题目内容
20.硫代硫酸钠溶液与稀硫酸的反应方程式为:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,分别进行了四组实验,数据记录如下,出现沉淀所需时间最短的是( )| 温度(℃) | Na2S2O3溶液 | H2SO4溶液 | H2O的体积 | 出现沉淀所需时间 | |||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| A | 0 | 5mL | 0.1mol/L | 10mL | 0.1mol/L | 5mL | |
| B | 0 | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | |
| C | 30 | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | |
| D | 30 | 5mL | 0.1mol/L | 10mL | 0.1mol/L | 5mL | |
| A. | A | B. | B | C. | C | D. | D |
分析 化学反应速率的影响因素是反应物浓度、反应温度,相同条件下浓度越大、温度越高反应速率越大,温度影响比浓度改变对反应速率影响大,结合图表数据和影响反应速率的因素分析;
解答 解:AB两组数据的不同点是稀硫酸的体积、水的体积、出现沉淀的时间,A中稀硫酸的浓度比B中小,A中出现沉淀比B中早,所以A反应速率比B中大,CD两组溶液中温度相同,物质浓度相同,不同点是:C中水的体积大于D,则D中出现的沉淀比C早,所以,Ⅲ的反应速率比Ⅱ大,所以其它条件一定时,反应物浓度越大速率越快,
AD中只有温度不同,温度越高出现沉淀速率越大,则D中反应速率大于A,所以其它条件一定时,温度越高,速率越快,出现沉淀所需时间最短的是D,
故选D.
点评 本题考查了影响很小反应速率的因素分析判断,主要是图表的分析方法:先比较两组数据的不同点,再分析不同点说明的问题,从而确定它们之间关系,两组数据,不同点是稀硫酸的体积、水的体积、出现沉淀的时间,稀硫酸的体积、水的体积不同,说明溶液的浓度不同;出现沉淀的时间不同,说明反应速率不同;根据浓度、速率的不同找出浓度与速率的关系,题目难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
10.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4~7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”)

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在4.4~7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”)
11.已知乙烯分子中碳原子以3个sp2杂化轨道与碳原子或氢原子形成σ键,两个碳原子上未参与杂化的p轨道形成π键.下列关于乙烯分子的叙述中正确的是( )
| A. | 乙烯分子2个碳原子和4个氢原子不可能在同一个平面内 | |
| B. | 乙烯分子中键角约为109°28′,所有原子在同一个平面内 | |
| C. | 乙烯分子中碳碳双键的键能比乙烷分子中碳碳单键的键能小 | |
| D. | 乙烯比乙烷活泼,说明碳碳之间的π键比σ键键能小,易发生反应 |
8.下列表达方式或说法正确的是( )
| A. | CO2的分子模型示意图: | B. | 某R元素原子的电子排布图: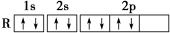 | ||
| C. | p-p π键电子云模型: | D. | 乙烯分子的球棍模型: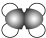 |
15.下列物质的类别与所含官能团的书写都正确的是( )
| A. |  酚类-OH 酚类-OH | B. |  羧酸-CHO 羧酸-CHO | ||
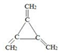
| C. | CH3CH=CHCH=CH2 烯烃 C=C | D. | CH3-O-CH3 醚类 |
5.下列各项内容中,排列顺序正确的是( )
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②物质的熔点Li>Na>K
③微粒半径:K+>S2->F-
④单质的密度Na<K<Rb
⑤氢化物的沸点:H2Se>H2S>H2O.
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②物质的熔点Li>Na>K
③微粒半径:K+>S2->F-
④单质的密度Na<K<Rb
⑤氢化物的沸点:H2Se>H2S>H2O.
| A. | ①③⑤ | B. | ①②④ | C. | ④⑤ | D. | ①② |
12.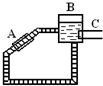 太阳能的开发和利用是21世纪的一个重要课题.
太阳能的开发和利用是21世纪的一个重要课题.
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
其中最适宜作储能介质的是B(填字母).
A、CaCl2•6H2O B、Na2SO4•10H2O C、Na2HPO4•12H2O D、Na2S2O3•5H2O
②如图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.根据
对水的密度的认识,你估计在阳光照射下水将沿顺(填“顺”或“逆”)时针方向流动.
 太阳能的开发和利用是21世纪的一个重要课题.
太阳能的开发和利用是21世纪的一个重要课题.①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
| 盐 | 熔点/℃ | 熔化吸热/KJ•mol-1 | 参考价格/元•kg-1 |
| CaCl2•6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 36.1 | 100.1 | 1600~2000 |
| Na2S2O3•5H2O | 48.5 | 49.7 | 1400~1800 |
A、CaCl2•6H2O B、Na2SO4•10H2O C、Na2HPO4•12H2O D、Na2S2O3•5H2O
②如图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.根据
对水的密度的认识,你估计在阳光照射下水将沿顺(填“顺”或“逆”)时针方向流动.

 .
.