题目内容
5.锰元素广泛分布在自然界中,其单质和化合物在工农业生产中有着重要的应用.(1)金属锰可用铝热法制得.已知Al的燃烧热为c kJ•mol-1,其余相关热化学方程式为:
3MnO2(s)═Mn3O4(s)+O2(g)△H1=a kJ•mol-1
3Mn3O4(s)+8Al(s)═9Mn(s)+4Al2O3(s)△H2=b kJ•mol-1
则3MnO2(s)+4Al(s)═3Mn(s)+2Al2O3(s)△H=a+$\frac{1}{3}$b-$\frac{4}{3}$c kJ•mol-1(用含a、b、c的代数式表示).
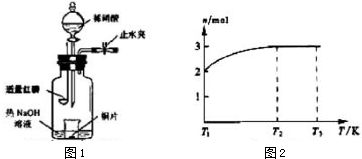
(2)MnCO3广泛用作锰盐原料.通过图1装置焙烧MnCO3可以制取MnO2,反应方程式为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g).

①2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g)的化学平衡常数表达式K=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$.
②用真空抽气泵不断抽气的目的除保证反应持续进行外,还有使平衡正向移动,提高MnCO3的转化率.
(3)MnO2常用作催化剂.MnO2催化降解甲醛的反应机理如图2所示,图中X表示的粒子是HCO3-,该反应的总反应方程式为HCHO+O2$\frac{\underline{\;MnO_2\;}}{\;}$CO2+H2O.
(4)MnSO4是重要微量元素肥料.用惰性电极电解MnSO4溶液可以制得更好活性的MnO2,电解时总反应的离子方程式为:Mn2++2H2O$\frac{\underline{\;通电\;}}{\;}$MnO2+H2↑+2H+,电解过程中阴极附近的pH增大(选填“增大”、“减小”或“不变”)
分析 (1)已知:①.3MnO2(s)═Mn3O4(s)+O2(g)△H1=akJ•mol-1
②.3Mn3O4(s)+8Al(s)═9Mn(s)+4Al2O3(s)△H2=bkJ•mol-1
由Al的燃烧热可得:③.Al(s)+$\frac{3}{4}$O2(g)=$\frac{1}{2}$Al2O3(s)△H=c kJ•mol-1,
根据盖斯定律,①+$\frac{1}{3}$×②+$\frac{4}{3}$×③可得:3MnO2(s)=Mn3O4(s)+O2(g),反应热也进行相应的计算;
(2)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
②用真空抽气泵不断抽气,可增大空气量,减少生成物浓度,平衡正向移动;
(3)氧离子与-CHO转化为X,而X与H+生成CO2和H2O,则X表示的粒子是HCO3-,整个过程是甲醛氧化生成二氧化碳与水;
(4)用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,由氧元素守恒可知有水参与反应,阴极发生还原反应,水放电生成氢气(还会生成氢氧根离子),配平书写电极反应式.
解答 解:(1)已知:①.3MnO2(s)=Mn3O4(s)+O2(g)△H1=a kJ•mol-1
②.3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s)△H2=b kJ•mol-1
由Al的燃烧热可得:③.Al(s)+$\frac{3}{4}$O2(g)=$\frac{1}{2}$Al2O3(s)△H=c kJ•mol-1,
根据盖斯定律,①+$\frac{1}{3}$×②+$\frac{4}{3}$×③可得:3MnO2(s)=Mn3O4(s)+O2(g),则△H=(a+$\frac{1}{3}$b-$\frac{4}{3}$c)kJ•mol-1,
故答案为:a+$\frac{1}{3}$b-$\frac{4}{3}$c;
(2)①2MnCO3(s)+O2(g)?2MnO2(s)+2CO(g)的化学平衡常数表达式K=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$,
故答案为:$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$;
②用真空抽气泵不断抽气,可增大空气量,减少生成物浓度,平衡正向移动,可提高MnCO3的转化率,
故答案为:使平衡正向移动,提高MnCO3的转化率;
(3)氧离子与-CHO转化为X,而X与H+生成CO2和H2O,则X表示的粒子是HCO3-,整个过程是甲醛氧化生成二氧化碳与水,可得该反应的总反应方程式为:HCHO+O2$\frac{\underline{\;MnO_2\;}}{\;}$CO2+H2O,
故答案为:HCO3-;HCHO+O2$\frac{\underline{\;MnO_2\;}}{\;}$CO2+H2O;
4)用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,阴极水得电子发生还原反应生成氢气,总反应离子方程式为:Mn2++2H2O$\frac{\underline{\;通电\;}}{\;}$MnO2+H2↑+2H+,阴极附近氢氧根浓度增大,则电解过程中阴极附近的pH增大,
故答案为:Mn2++2H2O$\frac{\underline{\;通电\;}}{\;}$MnO2+H2↑+2H+;增大.
点评 本题考查盖斯定律计算反应热、化学平衡常数及影响因素、电解原理等,侧重考查学生对知识迁移运用,难度中等.

| A. | 除去水中的HClO | B. | 紫外线杀菌消毒 | C. | 增加水中含氧量 | D. | 提高水温 |
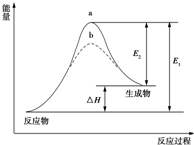
| A. | 该反应的反应热△H=E2-E1 | B. | 该反应为放热反应 | ||
| C. | 催化剂能改变反应的活化能 | D. | 催化剂能改变反应的焓变 |
| A. | 目前我国流通的硬币是由合金材料制成的 | |
| B. | Al与S直接化合可以得到Al2S3,则Fe与S直接化合也可以得到Fe2S3 | |
| C. | 黄铜耐腐蚀性强,不能与稀盐酸反应 | |
| D. | 某金(Au)合金的组成可表示为CuAu3.,其中金为-3价 |
| A. | 利用聚光手电筒照射,可以区别溶液和胶体 | |
| B. | 溶液、胶体、悬浊液和乳浊液等分散系中的溶质均以分子形式存在 | |
| C. | 分散质粒子的直径在1×10-9~1×10-7m之间的分散系属于胶体 | |
| D. | 自来水厂常用某些铁盐或铝盐作净水剂 |
| A. | 非金属性:Cl>Br | B. | 金属性:Al>Mg | ||
| C. | 热稳定性:H2O>H2S | D. | 酸性:H3PO4>H3AsO4 |
| A. | 把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol•L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算 | |
| B. | 将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol | |
| C. | 现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
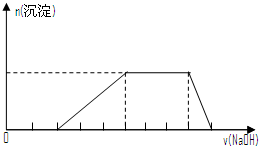
| D. | 某溶液中可能含有H+、Na+、NH${\;}_{4}^{+}$、Mg2+、Fe3+、Al3+、SO${\;}_{4}^{2-}$等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH${\;}_{4}^{+}$、Mg2+、Al3+ |
| A. | Zn 为正极,Ag2O 为负极 | |
| B. | 电解质溶液中,OH-移向 Ag2O 极 | |
| C. | 锌发生还原反应,氧化银发生氧化反应 | |
| D. | 原电池工作时,正极区溶液 pH 值增大 |
 .
.