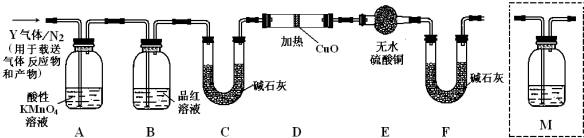
题目内容
6.(1)写出下列物质的电子式:①KOH
 ②CO2
②CO2
(2)用电子式表示下列物质的形成过程:
③Na2S
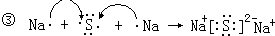 ④H2O
④H2O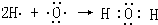 .
.
分析 (1)①氢氧化钾为离子化合物,电子式需要标出阴阳离子所带电荷;②二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;
(2)在元素符号周围用小黑点“•”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式,用电子式表示化合物形成过程时,应先判定化合物类型,若为离子化合物,则用箭头表示电子的移动,若为共价化合物,则不需要箭头表示.
解答 解:(1)①氢氧化钾中存在钾离子和氢氧根离子,氢氧化钾的电子式为: ;
;
②二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ;
;
故答案为: 、
、 ;
;
(2)③硫化钠为离子化合物,离子和原子都满足8电子稳定结构,离子键形成过程为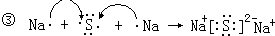 ,故答案为:
,故答案为: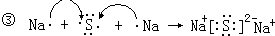 ;
;
④H2O属于共价化合物,氢原子最外层电子与氧原子最外层电子形成两对共用电子对,其形成过程可写为: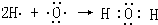 ,故答案为:
,故答案为: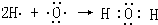 .
.
点评 本题考查电子式书写,难度不大,应判断化学式中,原子间的化学键类型,再用电子式写出其形成过程.

练习册系列答案
相关题目
15.某化学反应的能量变化如图所示.下列有关叙述正确的是( )
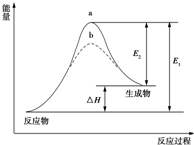

| A. | 该反应的反应热△H=E2-E1 | B. | 该反应为放热反应 | ||
| C. | 催化剂能改变反应的活化能 | D. | 催化剂能改变反应的焓变 |
17.下列说法正确的是( )

| A. | 把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol•L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算 | |
| B. | 将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol | |
| C. | 现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
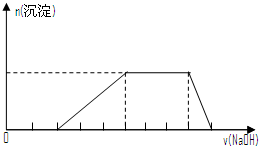
| D. | 某溶液中可能含有H+、Na+、NH${\;}_{4}^{+}$、Mg2+、Fe3+、Al3+、SO${\;}_{4}^{2-}$等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH${\;}_{4}^{+}$、Mg2+、Al3+ |
11.下列离子方程式书写正确的是( )
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ | |
| D. | 金属钠跟水反应:2Na+2H2O=2Na++2OH-+H2↑ |
18.下列说法正确的是( )
| A. | 天然气、煤和石油都是清洁能源 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 煤的干馏是物理变化,煤的气化和液化是化学变化 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |
15.电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为 KOH 溶液,其电极反应式是:Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-..下列说法正确的是( )
| A. | Zn 为正极,Ag2O 为负极 | |
| B. | 电解质溶液中,OH-移向 Ag2O 极 | |
| C. | 锌发生还原反应,氧化银发生氧化反应 | |
| D. | 原电池工作时,正极区溶液 pH 值增大 |
 .
.
 ;
; .
.