题目内容
13.0.1mol•L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA.× (判断对错)分析 依据n=CV可知要计算溶质的物质的量需要知道溶液的浓度和溶液的体积,据此判断解答.
解答 解:0.1mol•L-1的NaHSO4溶液,体积未知,无法计算硫酸氢钠的物质的量,无法计算阳离子个数,故错误;
点评 本题考查了有关物质的量浓度计算,明确计算公式是解题关键,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
3.碱式氯化镁(MgOHCl)常用于塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创.某科研小组同学根据该原理设计了如图实验装置来制备碱式氯化镁并探究氨的催化氧化反应,其中CuO的质量为8.0g.
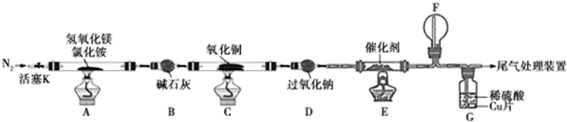
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)反应过程中持续通入N2的作用有两点:一是使装置A中产生的氨气完全导出,二是防止倒吸.
(3)一段时间后,你认为装置F中可观察到什么现象?生成红棕色气体.
(4)用离子方程式解释装置G中溶液变成蓝色的原因:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O.
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,则红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
(6)请你设计一个实验方案,证明装置C中完全反应后的红色固体中含氧化亚铜.
已知:①Cu2O+H+=Cu2++Cu ②限选试剂:2mol/LH2SO4溶液、12mol/LH2SO4溶液、2mol/LHNO3溶液、10mol/LHNO3溶液

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)反应过程中持续通入N2的作用有两点:一是使装置A中产生的氨气完全导出,二是防止倒吸.
(3)一段时间后,你认为装置F中可观察到什么现象?生成红棕色气体.
(4)用离子方程式解释装置G中溶液变成蓝色的原因:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O.
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,则红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
(6)请你设计一个实验方案,证明装置C中完全反应后的红色固体中含氧化亚铜.
已知:①Cu2O+H+=Cu2++Cu ②限选试剂:2mol/LH2SO4溶液、12mol/LH2SO4溶液、2mol/LHNO3溶液、10mol/LHNO3溶液
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | \ |
| 步骤2:向试管中加入2mol/LH2SO4溶液 | 液中出现蓝色,说明红色固体中含有Cu2O |
4.常温下,下列溶液可以用铁罐车装运的是( )
| A. | 氢氧化钠溶液 | B. | 浓硫酸 | C. | 浓盐酸 | D. | 稀硝酸 |
5.化学与生产、生活密切相关,下列叙述错误的是( )
| A. | 饱和Na2SO4溶液可以使蛋白质变性 | |
| B. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| C. | 从海带中提取碘单质的过程涉及氧化还原反应 | |
| D. | 镀锌铁桶镀层破损后铁仍不易被腐蚀 |
2.下列离子方程式中,正确的是( )
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| B. | 溴化亚铁溶液中通入足量的氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 少量的CO2通入稀的碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-反应完全2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
3.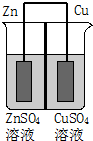 如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )
如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )
 如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )
如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )| A. | Zn2+通过隔膜从负极区向正极区移动 | |
| B. | 电子由Cu极通过导线流向Zn极 | |
| C. | 一段时间后ZnSO4溶液浓度增大CuSO4溶液浓度减小 | |
| D. | Cu2+与Zn2+物质的量之和保持不变 |