题目内容
14.250C时,0.1mol•L-1稀醋酸加水稀释,如图中的纵坐标y可以是( )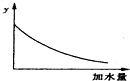
| A. | 溶液的pH | B. | 醋酸的电离平衡常数 | ||
| C. | 溶液的导电能力 | D. | 醋酸的电离程度 |
分析 醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,溶液的导电能力与离子浓度成正比,温度不变,醋酸的电离平衡常数不变,据此分析解答.
解答 解:A.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度逐渐减少,溶液的pH逐渐增大,但始终小于7,故A错误;
B.温度不变,醋酸的电离平衡常数不变,故B错误;
C.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子、醋酸根离子浓度逐渐减少,溶液的导电能力逐渐减小,故C正确;
D.加水稀释促进醋酸电离,则醋酸的电离程度增大,故D错误;
故选C.
点评 本题考查了弱电解质的电离,题目难度中等,明确加水稀释对醋酸电离程度的影响是解本题关键,知道溶液导电能力与离子浓度成正比,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
2.溶有NaBr.KI的溶液中,通入足量氯气充分反应,然后将所得溶液蒸干灼烧,所得固体为( )
| A. | Br2 | B. | I2和 KCl | C. | I2.KCl和NaCl | D. | KCl和NaCl |
9.下列物质中,既能与盐酸反应,又能跟NaOH溶液反应的化合物是( )
①NaHCO3 ②Al ③Al2O3 ④Al(OH)3 ⑤Na2SO4.
①NaHCO3 ②Al ③Al2O3 ④Al(OH)3 ⑤Na2SO4.
| A. | ①③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
19.H+浓度均为0.01mol/L的盐酸和醋酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
| A. | 醋酸与锌反应放出的氢气多 | |
| B. | 盐酸与锌反应放出的氢气多 | |
| C. | 醋酸与锌反应速率大 | |
| D. | 盐酸和醋分别与锌反应的速度一样大 |
6. 可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:
可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:
①a1>a2
②a1<a2
③b1>b2
④b1<b2
⑤t1>t2
⑥t1=t2
⑦两图中阴影部分面积相等
⑧图中阴影部分面积更大.
以上说法中正确的是( )
 可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:
可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:①a1>a2
②a1<a2
③b1>b2
④b1<b2
⑤t1>t2
⑥t1=t2
⑦两图中阴影部分面积相等
⑧图中阴影部分面积更大.
以上说法中正确的是( )
| A. | ②④⑤⑦ | B. | ①④⑥⑧ | C. | ②③⑤⑧ | D. | ①③⑥⑦ |
4.不能证明HA是弱酸的是( )
| A. | 0.1 mol•L-1 NaA溶液pH=10 | B. | 0.01 mol•L-1 HA溶液的pH=4 | ||
| C. | pH=2的HA溶液稀释100倍后pH=3.5 | D. | HA溶液跟锌反应,放出H2很慢 |

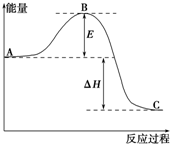 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: