题目内容
短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是( )
| A、原子序数A>B |
| B、电子总数A>B |
| C、离子半径A->B2+ |
| D、原子半径A>B |
考点:微粒半径大小的比较
专题:元素周期律与元素周期表专题
分析:A-和B2+离子具有相同的电子层结构,设A的核电核数为a,B的核电核数为b,则有a+1=b-2,即a<b,以此解答该题.
解答:
解:A-和B2+离子具有相同的电子层结构,设A的核电核数为a,B的核电核数为b,则有a+1=b-2,即a<b,
A.由以上分析可知,原子序数A<B,故A错误;
B.A-和B2+离子具有相同的电子层结构,则离子的电子数相同,所以原子的电子数:A<B,故B错误;
C.原子核外电子排布相同的离子,核电核数越大,则离子半径越小,核电荷数:A<B,则离子半径:A->B2+,故C正确;
D.A-和B2+离子具有相同的电子层结构,说明B在A的下一周期,比A多一个电子层,原子的核外电子层数越多,半径越大,则原子半径A<B,故D错误.
故选C.
A.由以上分析可知,原子序数A<B,故A错误;
B.A-和B2+离子具有相同的电子层结构,则离子的电子数相同,所以原子的电子数:A<B,故B错误;
C.原子核外电子排布相同的离子,核电核数越大,则离子半径越小,核电荷数:A<B,则离子半径:A->B2+,故C正确;
D.A-和B2+离子具有相同的电子层结构,说明B在A的下一周期,比A多一个电子层,原子的核外电子层数越多,半径越大,则原子半径A<B,故D错误.
故选C.
点评:本题考查原子结构与元素周期律的关系,题目难度不大,本题注意把握粒子半径的比较方法.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
将过量的二氧化碳通入下列溶液中,最终会出现浑浊的是( )
| A、氯化钙溶液 | B、澄清的石灰水 |
| C、水玻璃 | D、硝酸钡溶液 |
下列用来表示物质变化的化学用语中,正确的是( )
| A、NH4NO3溶液呈酸性的原因:NH4++H2O=NH3?H2O+H+ |
| B、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ |
| C、硫酸氢钠溶液中滴加少量Ba(OH)2溶液的离子方程式:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
D、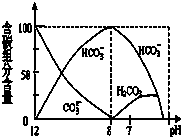 如图是在0.1 mol?L-1Na2CO3溶液中逐滴加入0.1 mol?L-1 HCl,则 pH=7时的离子方程式:H++HCO3-=CO2↑+H2O |
微观粒子是化学研究的主要对象.若阿伏加德罗常数为6.02×1023mol-1,下列对粒子数判断正确的是( )
| A、常温常压下,2.24L H2O2气体中含有的分子数为0.1×6.02×1023 |
| B、46 g NO2和N2O4混合气体中含有原子数为3NA |
| C、100 mL 0.2 mol/L的Fe2(SO4)3溶液中,含有的Fe3+数为0.1×0.2×6.02×1023 |
| D、25℃时,纯水中含有的H+数为1×10-7×6.02×1023 |