题目内容
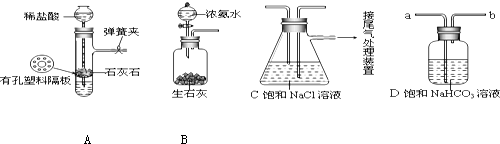
6. 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒
(2)在实验过程中,该同学需要测定并记录的实验数据有BDF(填序号).
A.盐酸的浓度B.盐酸的温度C.氢氧化钠溶液的浓度D.氢氧化钠溶液的温度
E.水的比热容F.反应后混合溶液的终止温度
(3)中和反应,三次实验温度平均升高3.4℃.已知中和后生成的溶液的比热容为4.18J/(g•℃),酸与碱溶液的密度均为1g/cm3.通过计算可得中和热△H= -56.8kJ•mol-1,
(4)实验中改用60mL0.50mol•L-1盐酸跟50mL0.55mol•L-1NaOH溶液进行反应,与上述正确的实验操作相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
分析 (1)根据中和热的操作步骤判断使用仪器及缺少仪器;
(2)根据反应放出热量Q=m•c•△T判断;
(3)先根据反应方程式计算生成水的物质的量,再根据比热容计算放出的热量,放出的热量除以水的物质的量就是中和热;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
解答 解:(1)中和热测定实验中,为了使酸碱充分反应,还需要用到环形玻璃搅拌棒,图示装置中还缺少的仪器为环形玻璃搅拌棒,
故答案为:环形玻璃搅拌棒;
(2)计算酸碱中和反应放出的热量表达式为Q=m•c•△T,则在该实验过程中,该同学需要测定的实验数据有:B.盐酸的温度、D.氢氧化钠溶液的温度、F.反应后混合溶液的终止温度,
故答案为:BDF;
(3)放出的热量Q=4.18J/(g•℃)×100g×3.4℃=1421.2J=1.4212kJ,50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH的稀烧碱溶液反应生成水的物质的量是:0.50mol/L×0.05L=0.025mol,所以生成1mol水放出的热量为:$\frac{1.4212kJ}{0.025mol}$=56.8kJ/mol,则中和热△H=-56.8kJ•mol-1,
故答案为:-56.8kJ•mol-1;
(4)反应放出的热量和所用酸以及碱的量的多少有关,用60mL0.50mol•L-1盐酸跟50mL0.55mol•L-1NaOH溶液进行上述实验时生成水的量增多,放出的热量会偏高;由于中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol•L-1盐酸跟50mL0.55mol•L-1NaOH溶液进行实验,与用50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液的实验测得中和热数值相等,
故答案为:不相等;相等.
点评 本题考查了中和热的测定方法,题目难度中等,明确测定中和热的原理是解题的关键,注意掌握中和热的概念及计算方法,试题培养了学生的分析能力及化学实验能力.

 智能训练练测考系列答案
智能训练练测考系列答案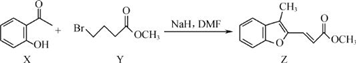
| A. | 物质 X在空气中不易被氧化 | |
| B. | 物质 Y中只含一个手性碳原子 | |
| C. | 物质 Z中所有碳原子不可能在同一平面内 | |
| D. | 等物质的量的 X、Y分别与 NaOH反应,最多消耗 NaOH的物质的量之比为 1:2 |
| A. | 钠着火后,可用泡沫灭火器来灭火 | |
| B. | 氧化钠和过氧化钠都属于碱性氧化物 | |
| C. | 过氧化钠与水的反应中,Na2O2作氧化剂,水作还原剂 | |
| D. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 |
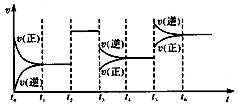 某密闭容器中发生反应:X(g)+3Y(g)?2Z(g)△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生反应:X(g)+3Y(g)?2Z(g)△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )| A. | t2时加入了催化剂 | |
| B. | t3时平衡的移动可使化学平衡常数减小 | |
| C. | t5时增大了压强 | |
| D. | t6时达到平衡后反应物的转化率最大 |
| A. | Fe2(SO4)3和 Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| B. | 碳酸钡加入稀硫酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ |
 CO2和CH4均为温室气体,研究它们具有重要的意义.
CO2和CH4均为温室气体,研究它们具有重要的意义.(1)已知CH4、H2、CO的燃烧热△H分别为-890.3kJ/mol、-285.8kJ/mol、-283.0kJ/mol则CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.3kJ/mol.
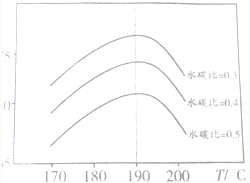
(2)以CO2和NH3为原料合成尿素是研究CO2的成功范例.在尿素合成塔中反应如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-86.98kJ/mol反应中影响CO2平衡转化率的因素很多,如图为特定条件下,不同水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$和温度对CO2平衡转化率的影响曲线.
①为提高CO2的转化率,生产中除控制温度外,还可采取的措施有增大压强、降低水碳比
②当温度高于190℃,CO2平衡转化率出现如图所示的变化趋势,其原因是温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低
(3)向1.0L的密闭容器中通入0.2mol NH3和0.1mol CO2,在一定的温度下,发生反应2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g),反应时间与气体总压强p的数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 65 | 80 | 100 |
| 总压强p/100kPa | 9.53 | 7.85 | 6.37 | 5.78 | 5.24 | 4.93 | 4.67 | 4.45 | 4.45 |
(4)氨基甲酸铵NH2COONH4极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;NH4+水解平衡常数值为4×10-9.
| A. | 容器内每减少1mol A2,同时生成2mol AB3 | |
| B. | 容器内每减少1mol A2,同时消耗3mol B2 | |
| C. | 容器内每减少1mol A2,同时消耗1mol B2 | |
| D. | 容器内每减少1mol A2,同时生成3mol B2 |
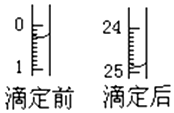 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.