题目内容
8.下列分子中所有原子都满足最外层8电子结构的是( )| A. | CH4 | B. | PCl3 | C. | PCl5 | D. | H2O |
分析 对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,据此判断.
解答 解:A.CH4中H原子的最外层电子为:1+1=2,不都满足8电子稳定结构,故A错误;
B.PCl3中P元素化合价为+3,P原子最外层电子数为5,所以3+5=8,P原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故B正确;
C.PCl5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,P原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故C错误;
D.H2O中H原子的最外层电子为:1+1=2,不都满足8电子稳定结构,故D错误.
故选B.
点评 本题考查8电子结构的判断,难度不大,清楚元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构是关键,注意离子化合物不适合.

练习册系列答案
相关题目
19.下列变化过程需要克服共价键的是( )
| A. | I2升华 | B. | 烧碱熔化 | ||
| C. | HCl溶于水 | D. | 溴蒸气被活性炭吸附 |
16.某单质(金属或非金属)跟足量的浓硫酸反应,每有1.5mol的单质反应就消耗3mol的H2SO4,则单质中的元素被氧化后的化合价可能是下列中的( )
①+1 ②+2 ③+3 ④+4.
①+1 ②+2 ③+3 ④+4.
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
3.关于丙醇(CH3CH2CH2OH)分子的说法正确的是( )
| A. | 分子中共含有11个极性键 | B. | 分子中含有配位键 | ||
| C. | 分子中只含σ键 | D. | 分子中含有1个π键 |
13.下列叙述正确的是( )
| A. | 非金属原子间以共价键结合的物质一定是共价化合物 | |
| B. | 凡是含有离子键的化合物一定是离子化合物 | |
| C. | 凡是能电离出离子的化合物一定是离子化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
20.短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
(1)D原子结构示意图为: ,E在周期表中的位置为:第三周期第ⅦA族.
,E在周期表中的位置为:第三周期第ⅦA族.
(2)B和C形成的化合物的电子式为: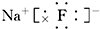 .
.
(3)B和D简单离子的半径大小为:F->Al3+.
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是:ae(填序号).
a.比较两种单质的颜色 b.比较两种单质与H2化合的难易程度
c.依据两元素在周期表中的位置 d.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1:4,相对分子质量为154,则该物质的化学式为:CCl4.
| 元素编号 | 元 素 特 征 信 息 |
| A | 最外层电子数是次外层电子数的2倍 |
| B | 和E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
 ,E在周期表中的位置为:第三周期第ⅦA族.
,E在周期表中的位置为:第三周期第ⅦA族.(2)B和C形成的化合物的电子式为:
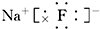 .
.(3)B和D简单离子的半径大小为:F->Al3+.
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是:ae(填序号).
a.比较两种单质的颜色 b.比较两种单质与H2化合的难易程度
c.依据两元素在周期表中的位置 d.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1:4,相对分子质量为154,则该物质的化学式为:CCl4.
15. 航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:
航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:
(1)N2H4、H2O2的组成元素中第一电离能最大的元素是N(填元素符号),1molN2H4分子中所含σ键的数目为5NA.
(2)基态钛原子的核外电子排布式为1s22s22p63s23p63d24s2,其未成对电子数为2.
(3)H2O2受热易分解为H2O,H2O的空间构型为V形,其中心原子的杂化轨道类型为sp3杂化,H2S和H2O2的主要物理性质如下表,造成二者物理性质差异的主要原因是H2O2的分子之间形成氢键,沸点高于硫化氢的,H2O2与H2O分子之间也可以形成氢键,H2O2在水中的溶解度大于H2S的.
(4)氧化镁与氮化硼均可用作航天器返回舱的热屏蔽材料,晶格能:氧化镁大于(填“大于”或“小于”)氧化钙,其原因是镁离子半径小于钙离子半径.
(5)立方氮化硼的晶胞如图所示,则处于晶胞顶点的原子的配位数为4,若晶胞边长为acm,则立方氮化硼的密度是$\frac{100}{{a}^{3}{N}_{A}}$g•cm-3(设NA为阿伏伽德罗常数的数值).
 航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:
航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:(1)N2H4、H2O2的组成元素中第一电离能最大的元素是N(填元素符号),1molN2H4分子中所含σ键的数目为5NA.
(2)基态钛原子的核外电子排布式为1s22s22p63s23p63d24s2,其未成对电子数为2.
(3)H2O2受热易分解为H2O,H2O的空间构型为V形,其中心原子的杂化轨道类型为sp3杂化,H2S和H2O2的主要物理性质如下表,造成二者物理性质差异的主要原因是H2O2的分子之间形成氢键,沸点高于硫化氢的,H2O2与H2O分子之间也可以形成氢键,H2O2在水中的溶解度大于H2S的.
| 熔点/K | 沸点/K | 水中溶解度(标准状况下) | |
| H2S | 187 | 202 | 每升水中溶解2.6L |
| H2O2 | 272 | 423 | 以任意比互溶 |
(5)立方氮化硼的晶胞如图所示,则处于晶胞顶点的原子的配位数为4,若晶胞边长为acm,则立方氮化硼的密度是$\frac{100}{{a}^{3}{N}_{A}}$g•cm-3(设NA为阿伏伽德罗常数的数值).