题目内容
16.某单质(金属或非金属)跟足量的浓硫酸反应,每有1.5mol的单质反应就消耗3mol的H2SO4,则单质中的元素被氧化后的化合价可能是下列中的( )①+1 ②+2 ③+3 ④+4.
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
分析 ①若单质为金属单质,设为M,化合价为+x,则反应的方程式为:2M+2xH2SO4=M2(SO4)x+xSO2+2xH2O;每有1.5mol的单质反应就消耗3mol的H2SO4,则反应的物质的量之比为1:2,所以$\frac{2}{2x}=\frac{1}{2}$,解之得x=2;
②若单质为非金属单质,则与足量的浓硫酸反应时,反应的浓硫酸均作为氧化剂,根据氧化还原过程中得失电子守恒可知3molH2SO4反应要得到6mol电子,即可知元素在生成物中所显示的化合价为+4价,由此分析解答.
解答 解:①若单质为金属单质,设为M,化合价为+x,则反应的方程式为:2M+2xH2SO4=M2(SO4)x+xSO2+2xH2O;每有1.5mol的单质反应就消耗3mol的H2SO4,则反应的物质的量之比为1:2,所以$\frac{2}{2x}=\frac{1}{2}$,解之得x=2;
②若单质为非金属单质,则与足量的浓硫酸反应时,反应的浓硫酸均作为氧化剂,根据氧化还原过程中得失电子守恒可知2molH2SO4反应要得到6mol电子,所以1.5mol的单质失去6mol的电子,即可知元素在生成物中所显示的化合价为+4价,故选C.
点评 本题考查氧化还原反应的有关计算,难度中等,确定单质与硫酸的量的关系是解题的关键,为易错题目,学生容易忽略浓硫酸与非金属的反应情况.

练习册系列答案
相关题目
6.X、Y、Z是原子序数依次增大的短周期主族元素,X2-、Z+都与Mg2+具有相同的核外电子层结构,下列说法中正确的是( )
| A. | Y元素位于第二周期第ⅦA族或0族 | |
| B. | X、Y、Z三种元素中非金属性最强的是X元素 | |
| C. | Y的最高氧化物对应的水化物是已知酸中最强的酸 | |
| D. | Z分别与X、Y形成的化合物都是离子化合物 |
7.下列关于有机物的命名中正确的是( )
| A. | 2-甲基-3-丁烯 | B. | 2-乙基戊烷 | ||
| C. | 3-甲基-1,3-丁二烯 | D. | 2,3-二甲基己烷 |
4.如图所示有关浓硫酸性质的实验装置中,实验开始一段时间后,对看到的现象叙述及原因解释都正确的是( )
| A. | 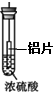 铝片无明显变化,说明浓硫酸与铝片不反应 | |
| B. | 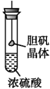 胆矾晶体表面有“白斑”,说明浓硫酸具有脱水性 | |
| C. | 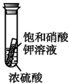 小试管内有晶体析出,说明浓硫酸具有吸水性 | |
| D. | 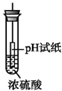 pH试纸变红,说明浓硫酸具有酸性 |
11.下列化学反应的离子方程式正确的是( )
| A. | 往NaOH溶液中通入过量SO2:SO2+2OH-═SO32-+H2O | |
| B. | 锌与稀硝酸反应:Zn+2H+═Zn2++H2↑ | |
| C. | 向氯化铵的溶液中加入足量浓KOH溶液并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3•H2O | |
| D. | 向氯水中通入SO2气体:Cl2+SO2+2H2O═4H++2Cl-+SO42- |
1.金属的下列性质中,与自由电子无关的是( )
| A. | 密度大小 | B. | 容易导电 | C. | 延展性好 | D. | 易导热 |
8.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | CH4 | B. | PCl3 | C. | PCl5 | D. | H2O |
5. 盆烯是近年合成的一种有机物,它的分子结构可用如图表示(其中碳、氢原子均已略去),下面关于盆烯的说法错误的是( )
盆烯是近年合成的一种有机物,它的分子结构可用如图表示(其中碳、氢原子均已略去),下面关于盆烯的说法错误的是( )
 盆烯是近年合成的一种有机物,它的分子结构可用如图表示(其中碳、氢原子均已略去),下面关于盆烯的说法错误的是( )
盆烯是近年合成的一种有机物,它的分子结构可用如图表示(其中碳、氢原子均已略去),下面关于盆烯的说法错误的是( )| A. | 盆烯的分子中所有的碳原子共一平面 | |
| B. | 盆烯是苯的一种同分异构体 | |
| C. | 盆烯与乙烯的官能团相同 | |
| D. | 盆烯可以在一定条件下发生加成反应 |
3.以下有关接触法制硫酸的论述错误的是( )
| A. | 为提高反应速率和原料利用率,硫铁矿要在“沸腾”状态下燃烧 | |
| B. | 为防止催化剂中毒,气体在进接触室前要先净化 | |
| C. | 接触室中热交换器的主要作用是预热未反应的气体和冷却反应后的气体 | |
| D. | 吸收塔中SO3从下而上,水从上而下喷,剩余气体从上部出来循环利用 |