题目内容
下列叙述中,正确的是( )
| A、硅化学性质很稳定,因此硅在自然界中以游离态形式存在 |
| B、实验结束后,将废液倒入下水道排出实验室,以免污染实验室 |
| C、实验室盛装NaOH溶液的试剂瓶要用橡皮塞而不用玻璃塞 |
| D、向待测液先滴加新制氯水再滴加KSCN溶液,溶液变成血红色,说明待测液中一定有Fe2+ |
考点:硅和二氧化硅,化学试剂的存放,化学实验方案的评价
专题:
分析:A.硅在自然界中以化合态形式存在;
B.废液倒入下水道排会污染地下水;
C.氢氧化钠与玻璃的成分二氧化硅反应生成具有粘性的硅酸钠,将瓶塞与瓶体黏在一起,打不开;
D.先滴加氯水,氯气将Fe2+氧化成Fe3+,即使原溶液不含Fe3+,滴加KSCN溶液后也显红色.
B.废液倒入下水道排会污染地下水;
C.氢氧化钠与玻璃的成分二氧化硅反应生成具有粘性的硅酸钠,将瓶塞与瓶体黏在一起,打不开;
D.先滴加氯水,氯气将Fe2+氧化成Fe3+,即使原溶液不含Fe3+,滴加KSCN溶液后也显红色.
解答:
解:A.虽然硅的化学性质很稳定,但在自然界中仍以化合态形式存在,如二氧化硅、硅酸盐等,故A错误;
B.实验结束后,不能将废液倒入下水道排出实验室,这样容易污染地下水,应该放入废液回收缸中,故B错误;
C.玻璃的成分之一是二氧化硅,二氧化硅能与氢氧化钠反应生成具有粘性的硅酸钠而将瓶塞与瓶体黏在一起,取用药品时,打不开,故C正确;
D.先滴加氯水,氯气将Fe2+氧化成Fe3+,即使原溶液不含Fe3+,滴加KSCN溶液后也显红色,无法证明原溶液是否含有Fe3+,故D错误;
故选C.
B.实验结束后,不能将废液倒入下水道排出实验室,这样容易污染地下水,应该放入废液回收缸中,故B错误;
C.玻璃的成分之一是二氧化硅,二氧化硅能与氢氧化钠反应生成具有粘性的硅酸钠而将瓶塞与瓶体黏在一起,取用药品时,打不开,故C正确;
D.先滴加氯水,氯气将Fe2+氧化成Fe3+,即使原溶液不含Fe3+,滴加KSCN溶液后也显红色,无法证明原溶液是否含有Fe3+,故D错误;
故选C.
点评:本题是一道基础题,需要同学将基础知识掌握的很牢固.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
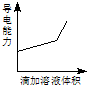 浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )
浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )| A | B | C | D | |
| 溶液(Ⅰ) | 盐酸 | 醋酸 | 氢氧化钠 | 氨水 |
| 溶液(Ⅱ) | 氢氧化钠 | 氢氧化钠 | 氨水 | 硝酸银 |
| A、A | B、B | C、C | D、D |
ICl能发生下列变化,其中变化时会破坏化学键的是( )
| A、升华 |
| B、熔化 |
| C、溶于CCl4 |
| D、受热分解 |
天然碱的化学式表示为2Na2CO3?NaHCO3?2H2O,取少量该物质溶于水得到稀溶液,在溶液中逐滴加入稀盐酸.下列离子方程式与事实不相符的是( )
| A、HCO3-+CO32-+3H+→2H2O+2CO2↑ |
| B、2HCO3-+CO32-+4H+→3H2O+3CO2↑ |
| C、CO32-+H+→HCO3- |
| D、HCO3-+3CO32-+7H+→4H2O+4CO2↑ |
下列说法不正确的是( )
| A、使用正催化剂可降低活化能,增加反应物活化分子的百分数 |
| B、升高温度可增加反应物活化分子的百分数 |
| C、增加反应物浓度可增加反应物活化分子的百分数 |
| D、对于有气体参加的可逆反应,加压可增大单位体积反应物活化分子的数目 |
关于元素周期律的叙述不正确的是( )
| A、同周期元素,从左到右电负性依次增大 |
| B、主族元素的最高化合价都等于最外层电子数(O、F除外) |
| C、同主族元素,从上到下,原子半径依次增大 |
| D、金属元素的正化合价越高,其对应的氢氧化物的碱性越强 |
下列溶液一定呈中性的是( )
| A、pH=7的溶液 |
| B、pH=2的CH3COOH和pH=12的NaOH溶液等体积混合 |
| C、CH3COONa溶液 |
| D、c(NH+4)=c(Cl-)的NH4Cl和氨水的混合溶液 |
关于晶体的结构和性质的说法中正确的是( )
| A、晶体和非晶体的区别,就是晶体有自范性,而非晶体没有 |
| B、常温下为气体或者液体的物质,固体时都是分子晶体 |
| C、原子晶体一定是单质元素的原子组成的 |
| D、金属晶体的熔沸点总比分子晶体的熔沸点高 |